题目内容
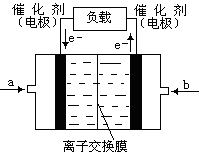
(14分)(1)二氧化硫的催化氧化的过程如图所示,
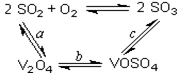
其中a、c二步的化学方程式可表示为:
SO2+V2O5 SO3+ V2O4
SO3+ V2O4
4VOSO4+O2 2V2O5+4SO3。
2V2O5+4SO3。
该反应的催化剂是 (写化学式)
(2)压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7%,O2 11%,N2 82%):
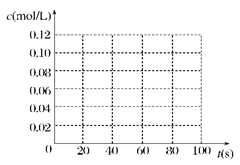
当合成SO3的反应达到平衡后,改变某一外界条件(不改变SO2、O2和SO3的量),反应速率与时间的关系如图所示。图中t1 时引起平衡移动的条件可能是 其中表示平衡混合物中SO3的含量最高的一段时间是 。

(3)550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如右图所示。将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应达平衡后,体系总压强为0.10 M Pa。试计算反应2SO3 2SO2+O2 在550 ℃时的平衡常数K= 。
2SO2+O2 在550 ℃时的平衡常数K= 。

反应达平衡后,下列措施中能使n(SO3)/n(SO2)增大的是
A.升高温度 B.充入He(g),使体系总压强增大
C.再充入2 mol SO2和1 mol O2 D.再充入1 mol SO2和1 mol O2
(4)SO3溶于水得到硫酸。在25°C下,将x mol·L-1的氨水与y mol·L-1的硫酸等体积混合,反应后溶液中显中性,则c(NH4+) 2 c(SO42-)(填“>”、“<”或“=”);用含x和y的代数式表示出氨水的电离平衡常数 。
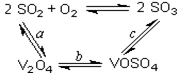
其中a、c二步的化学方程式可表示为:
SO2+V2O5
 SO3+ V2O4
SO3+ V2O4 4VOSO4+O2
 2V2O5+4SO3。
2V2O5+4SO3。该反应的催化剂是 (写化学式)
(2)压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7%,O2 11%,N2 82%):
| 压强/MPa 温度/℃ | 0.1[ | 0.5 | 1 | 10 |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |

(3)550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如右图所示。将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应达平衡后,体系总压强为0.10 M Pa。试计算反应2SO3
 2SO2+O2 在550 ℃时的平衡常数K= 。
2SO2+O2 在550 ℃时的平衡常数K= 。
反应达平衡后,下列措施中能使n(SO3)/n(SO2)增大的是
A.升高温度 B.充入He(g),使体系总压强增大
C.再充入2 mol SO2和1 mol O2 D.再充入1 mol SO2和1 mol O2
(4)SO3溶于水得到硫酸。在25°C下,将x mol·L-1的氨水与y mol·L-1的硫酸等体积混合,反应后溶液中显中性,则c(NH4+) 2 c(SO42-)(填“>”、“<”或“=”);用含x和y的代数式表示出氨水的电离平衡常数 。
(1)V2O5 (2)增大压强、t2—t3 (3)0.0025 C D (4)= K=2×10-7y /(x-2y)
(1)将abc三个反应相叠加,即得到2SO2+O2 2SO3,因此V2O5其催化剂作用。
2SO3,因此V2O5其催化剂作用。
(2)t1 时正逆反应速率都增大,但正反应速率大于逆反应速率,说明平衡向正反应方向移动,所以改变的条件是增大压强。由于t3时逆反应速率大于正反应速率,平衡向逆反应方向移动,所以平衡混合物中SO3的含量最高的一段时间是t2—t3。
(3)反应达平衡后,体系总压强为0.10 M Pa,此时转化率是0.80,所以生成三氧化硫是1.6mol,则平衡时二氧化硫和氧气分别是0.4mol、0.2mol,所以平衡常数K= ,则反应2SO3
,则反应2SO3 2SO2+O2 在550 ℃时的平衡常数K=1/400=0.0025。反应是放热反应,所以升高温度平衡向逆反应方向移动,n(SO3)/n(SO2)减小。充入He(g),使体系总压强增大,但物质的浓度不变,所以平衡不移动。C、D都相当于增大压强,平衡向正反应方向移动,所以n(SO3)/n(SO2)增大,答案选CD。
2SO2+O2 在550 ℃时的平衡常数K=1/400=0.0025。反应是放热反应,所以升高温度平衡向逆反应方向移动,n(SO3)/n(SO2)减小。充入He(g),使体系总压强增大,但物质的浓度不变,所以平衡不移动。C、D都相当于增大压强,平衡向正反应方向移动,所以n(SO3)/n(SO2)增大,答案选CD。
(4)根据电荷守恒c(NH4+)+c(H+)= 2c(SO42-)+c(OH-)可知,当溶液显中性时c(NH4+)= 2c(SO42-)=ymol/L。根据氮原子守恒可知,溶液中c(NH3·H2O)=(x/2-y)mol,所以平衡常数=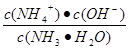 =2×10-7y /(x-2y)。
=2×10-7y /(x-2y)。
 2SO3,因此V2O5其催化剂作用。
2SO3,因此V2O5其催化剂作用。(2)t1 时正逆反应速率都增大,但正反应速率大于逆反应速率,说明平衡向正反应方向移动,所以改变的条件是增大压强。由于t3时逆反应速率大于正反应速率,平衡向逆反应方向移动,所以平衡混合物中SO3的含量最高的一段时间是t2—t3。
(3)反应达平衡后,体系总压强为0.10 M Pa,此时转化率是0.80,所以生成三氧化硫是1.6mol,则平衡时二氧化硫和氧气分别是0.4mol、0.2mol,所以平衡常数K=
 ,则反应2SO3
,则反应2SO3 2SO2+O2 在550 ℃时的平衡常数K=1/400=0.0025。反应是放热反应,所以升高温度平衡向逆反应方向移动,n(SO3)/n(SO2)减小。充入He(g),使体系总压强增大,但物质的浓度不变,所以平衡不移动。C、D都相当于增大压强,平衡向正反应方向移动,所以n(SO3)/n(SO2)增大,答案选CD。
2SO2+O2 在550 ℃时的平衡常数K=1/400=0.0025。反应是放热反应,所以升高温度平衡向逆反应方向移动,n(SO3)/n(SO2)减小。充入He(g),使体系总压强增大,但物质的浓度不变,所以平衡不移动。C、D都相当于增大压强,平衡向正反应方向移动,所以n(SO3)/n(SO2)增大,答案选CD。(4)根据电荷守恒c(NH4+)+c(H+)= 2c(SO42-)+c(OH-)可知,当溶液显中性时c(NH4+)= 2c(SO42-)=ymol/L。根据氮原子守恒可知,溶液中c(NH3·H2O)=(x/2-y)mol,所以平衡常数=
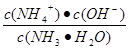 =2×10-7y /(x-2y)。
=2×10-7y /(x-2y)。
练习册系列答案
相关题目
 pC的可逆反应达到平衡:
pC的可逆反应达到平衡: N2O4(g) ,平衡后,向容器内再充入1molNO2,下列说法正确的
N2O4(g) ,平衡后,向容器内再充入1molNO2,下列说法正确的 C(g)+D(g) 已达到化学平衡状态的是
C(g)+D(g) 已达到化学平衡状态的是
 2C(g),达到平衡后,恢复至温度。下列有关说法不正确的是
2C(g),达到平衡后,恢复至温度。下列有关说法不正确的是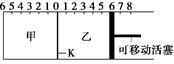
 2SO3并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为( )
2SO3并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为( ) CO(g)+3H2(g)
CO(g)+3H2(g)