题目内容
(8分)在一定条件下,mA+nB  pC的可逆反应达到平衡:
pC的可逆反应达到平衡:
(1)若A、B、C都是气体,减压后,V正<V逆,则m、n、p的关系是________。
(2)若C是气体,且m+n=p,加压时,化学平衡发生移动,则平衡是向________方向移动,原因是________。
(3)若升高温度,A的转化率降低,则此反应的逆反应是________热反应。
 pC的可逆反应达到平衡:
pC的可逆反应达到平衡:(1)若A、B、C都是气体,减压后,V正<V逆,则m、n、p的关系是________。
(2)若C是气体,且m+n=p,加压时,化学平衡发生移动,则平衡是向________方向移动,原因是________。
(3)若升高温度,A的转化率降低,则此反应的逆反应是________热反应。
(8分)(1) m+n>p
(2) 逆反应,A、B只能由一种是气体或都不是气体,因为加压,平衡发生移动,且C为气体 (3) 吸
(2) 逆反应,A、B只能由一种是气体或都不是气体,因为加压,平衡发生移动,且C为气体 (3) 吸
(1)减压后,V正<V逆,说明平衡向逆反应方向移动,所以正反应是条件减小的,则m+n>p。
(2)加压时,化学平衡发生移动,而C是气体,且m+n=p,所以平衡一定向逆反应方向移动。这是由于C为气体且m+n=p,所以A、B只能有一种是气体或都不是气体,只有这样加压,平衡才能发生发生移动。
(3)升高温度,A的转化率降低,说明平衡向逆反应方向移动,所以正反应是放热反应,则逆反应就是吸热反应。
(2)加压时,化学平衡发生移动,而C是气体,且m+n=p,所以平衡一定向逆反应方向移动。这是由于C为气体且m+n=p,所以A、B只能有一种是气体或都不是气体,只有这样加压,平衡才能发生发生移动。
(3)升高温度,A的转化率降低,说明平衡向逆反应方向移动,所以正反应是放热反应,则逆反应就是吸热反应。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
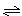 xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求: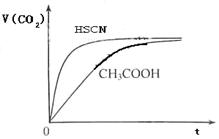
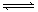 cC(g)+dD(g)达平衡后,保持温度不变,将容器体积压缩到原来的一半。当达到新的平衡时,D的浓度为原平衡时的1.6倍,则
cC(g)+dD(g)达平衡后,保持温度不变,将容器体积压缩到原来的一半。当达到新的平衡时,D的浓度为原平衡时的1.6倍,则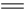 C(g) +D(g) △H-T△S="(-4500+11T)" J/mol,要防止反应发生,温度必须:
C(g) +D(g) △H-T△S="(-4500+11T)" J/mol,要防止反应发生,温度必须: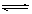 B(g) + D(g)在四种不同条件下进行,反应器均为相同恒容密闭容器,B、D起始浓度为0。反应物A的浓度(
B(g) + D(g)在四种不同条件下进行,反应器均为相同恒容密闭容器,B、D起始浓度为0。反应物A的浓度(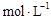 )随反应时间(min)的变化情况如下表:
)随反应时间(min)的变化情况如下表: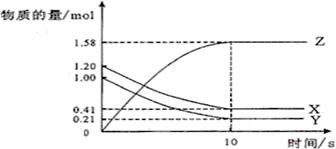
 Z(g)
Z(g)
 SO3+ V2O4
SO3+ V2O4 
 2SO2+O2 在550 ℃时的平衡常数K= 。
2SO2+O2 在550 ℃时的平衡常数K= 。