题目内容
1.某铜矿石的成分中含有Cu2O,还含有少量的Al2O3、Fe203和Si02.某工厂利用此矿石炼制精铜的工艺流程示意图如图1:
已知:Cu2O+2H+═Cu+Cu2++H2O
(1)滤液A中铁元素的存在形式为Fe2+(填离子符号),生成该离子的离子方程式为Cu+2Fe3+=Cu2++2Fe2+,检验滤液A中存在该离子的试剂为硫氰化钾溶液和新制氯水(填试剂名称).
(2)金属E与固体F发生的某一反应可用于焊接钢轨,该反应的化学方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe
(3)常温下.等pH的NaAl02和NaOH两份溶液中,由水电离出的c(OH一)前者为后者的108倍,则两种溶液的pH=11.
(4)将Na2CO3溶液滴入到一定量的CuCl2溶液中,除得到蓝色沉淀,还有无色无味气体放出,写出相应的离子方程式:Cu2++CO32-=CuCO3↓;Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑.
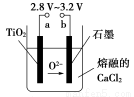
(5)①粗铜的电解精炼如图2所示.在粗铜的电解精炼过程中,c为粗铜板,则a端应连接电源的正(填“正”或“负”)极,若粗铜中含有Au、Ag、Fe杂质,则电解过程中c电极上发生反应的方程式有Fe-2e-=Fe2+、Cu-2e-=Cu2+.
②可用酸性高锰酸钾溶液滴定法测定反应后电解液中铁元素的含量.滴定时不能用碱式滴定管盛放酸性高锰酸钾溶液的原因是酸性高锰酸钾溶液有强氧化性,能腐蚀碱式滴定管上的橡胶管(或易使橡胶管老化),所以不能用碱式滴定管盛高锰酸钾溶液.滴定中发生反应的离子方程式为5Fe2++MnO42-+8H+=5Fe2++Mn2++4H2O,滴定时.锥形瓶中的溶液接触空气,则测得铁元素的含量会偏低(填“偏高”或“偏低”).
分析 某铜矿石的成分中含有Cu2O,还含有少量的Al2O3、Fe203和Si02,加入足量稀盐酸过滤固体混合物为Si02,Cu2O溶于酸反应生成铜和铜盐,滤液A中为亚铁离子,铝离子和铜离子,加入足量氢氧化钠溶液过滤得到固体混合物为氢氧化铜、氢氧化铁,滤液为C为AlO2-离子,通入二氧化碳生成氢氧化铝沉淀,氢氧化铝分解得到氧化铝,电解熔融氧化铝得到金属E为Al,固体混合物D空气中加热灼烧得到氧化铁和氧化铜,和铝发生铝热反应得到粗铜,含有铁杂质,粗铜精炼得到精铜;
(1)上述分析可知滤液A中,Cu2O溶于酸反应生成铜和铜盐,铜和铁离子反应生成亚铁离子,所以滤液A中为亚铁离子,检验滤液A中存在的亚铁离子可以用KSCN和氯水检验;
(2)铝热反应是铝和氧化铁反应生成铁;
(3)等pH的NaAl02和NaOH两份溶液中,NaAl02和促进水的电离显碱性,NaOH溶液抑制水的电离,由水电离出的c(OH一)前者为后者的108倍,结合溶液中离子积常数计算;
(4)Cu2+和CO32-生成CuCO3沉淀②Cu2+和CO32-和水反应生成Cu(OH)2沉淀和二氧化碳;
(5)①在粗铜的电解精炼过程中,c为粗铜板作阳极应连接电源的正极,c电极(即阳极)上铜和比铜活泼的铁发生反应的,方程式有 Fe-2e-=Fe2+;Cu-2e-=Cu2+;
②酸性高锰酸钾有强氧化性,能腐蚀碱式滴定管上的橡皮管(或易使橡皮管老化),故滴定时不能用碱式滴定管盛放酸性高锰酸钾溶液.亚铁离子用酸性高锰酸钾溶液滴定法测定,离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;空气中的氧气可将亚铁离子氧化,导致消耗高锰酸钾的量减少,测得铁元素的含量会偏低.
解答 解:(1)分析可知滤液A中,Cu2O溶于酸反应生成铜和铜盐,铜和铁离子反应生成亚铁离子,所以滤液A中为亚铁离子,生成该离子的离子方程式为,Cu+2Fe3+=Cu2++2Fe2+,检验滤液A中存在的亚铁离子可以用KSCN和氯水检验;
故答案为:Fe2+,Cu+2Fe3+=Cu2++2Fe2+,硫氰化钾溶液和新制氯水;
(2)铝热反应是铝和氧化铁反应生成铁,金属E与固体F发生的某一反应可用于焊接钢轨,该反应的化学方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;
(3)常温下.等pH的NaAl02和NaOH两份溶液中,设PH为x,NaAl02溶液中水电离出C(OH-)=$\frac{1{0}^{-14}}{1{0}^{-x}}$,NaOH溶液中水电离出氢氧根离子浓度C(OH-)=10-xmol/L,由水电离出的c(OH一)前者为后者的108倍,$\frac{1{0}^{-14}}{1{0}^{-x}}$=10-xm×108,x=11,则两种溶液的pH=11,
故答案为:1l;
(4)将Na2CO3溶液滴入到一定量CuCl2溶液中得到沉淀,Cu2+和CO32-生成CuCO3沉淀,离子方程式为:Cu2++CO32-=CuCO3↓,Cu2+和CO32-和水反应生成Cu(OH)2沉淀和二氧化碳,离子方程式为:Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑,
故答案为:Cu2++CO32-=CuCO3↓;Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑;
(5)①在粗铜的电解精炼过程中,c为粗铜板作阳极,则a端应连接电源的正极,若粗铜中含有Au、Ag、Fe杂质,则电解过程中c电极(即阳极)上铜和比铜活泼的铁发生反应的,方程式有 Fe-2e-=Fe2+;Cu-2e-=Cu2+,
故答案为:正;Fe-2e-=Fe2+、Cu-2e-=Cu2+;
②可以应用酸性高锰酸钾溶液滴定法测定反应后电解液中铁元素的含量.滴定时不能用碱式滴定管盛放酸性高锰酸钾溶液的原因是 酸性高锰酸钾有强氧化性,能腐蚀碱式滴定管上的橡皮管(或易使橡皮管老化).电解时铁变成了亚铁离子,用酸性高锰酸钾溶液滴定法测定反应后电解液中铁元素,离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;滴定时,锥形瓶中的溶液会接触空气,氧气可将亚铁离子氧化,导致消耗高锰酸钾的量减少,测得铁元素的含量会偏低.
故答案为:酸性高锰酸钾溶液有强氧化性,能腐蚀碱式滴定管上的橡胶管(或易使橡胶管老化),所以不能用碱式滴定管盛高锰酸钾溶液,5Fe2++MnO42-+8H+=5Fe2++Mn2++4H2O,偏低.
点评 本题考查了铜的单质及其化合物的性质及转化、电化学、氧化还原滴定等,涉及范围较广,综合性较强,题目难度中等.

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案| 单质 | a | b | c | d | e |
| 沸点(℃) | 58.8 | 882.9 | 444.7 | 2 355 | 1 107 |
(2)写出d的元素原子的电子式
 ;其最高价氧化物形成的晶体为原子晶体(填类型),d单质溶于强碱的离子方程式为Si+2OH-+H2O=SiO32-+2H2↑.
;其最高价氧化物形成的晶体为原子晶体(填类型),d单质溶于强碱的离子方程式为Si+2OH-+H2O=SiO32-+2H2↑.(3)c与氢形成的分子X的空间构型为V型;写出X的水溶液与足量b元素的最高价氧化物对应水化物反应的离子方程式H2S+2OH-=S2-+H2O.
(4)上述元素所能形成的简单离子中半径最小的是Mg2+(填离子符号),最高价氧化物对应水化物酸性最强的是HBrO4(填分子式),e元素与N元素形成化合物的电子式为
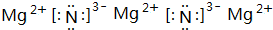 .
.(5)b元素与氯元素形成的化合物Y的晶体中,1个晶胞内含有的基本微粒及个数是4个Na+、4个Cl-.
①P4 ②NH3 ③CCl4 ④金刚石 ⑤CH4 ⑥SiO2 ⑦H2O ⑧CO2.
| A. | ①③④⑤ | B. | ①③④⑤⑥ | C. | ①③⑤ | D. | ④⑤ |
| A. | 相同温度下,0.2mol•L-1醋酸溶液与0.1mol•L-1醋酸中的c(H+ )之比 | |
| B. | 在Na2O2晶体中阳离子与阴离子的物质的量之比 | |
| C. | 液面均在“0”刻度时,50mL碱式滴定管和25mL碱式滴定管所盛溶液的体积之比 | |
| D. | 22.4LCO2与22.4L CO所含氧原子数目之比 |
 B
B
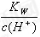 =0.1 mol•L-1的溶液:Na+、K+、SiO32-、NO3-
=0.1 mol•L-1的溶液:Na+、K+、SiO32-、NO3-