题目内容
16.随着核电荷数的递增,氧化性逐渐减弱的一组是( )| A. | Li+、Na+、Al3+、K+ | B. | F2、Cl2、Br2、I2 | C. | F-、Cl-、Br-、I- | D. | Li、Na、K、Rb |
分析 元素的金属性越强,对应离子的氧化性越弱,元素非金属性越强对应单质的氧化性越强,由此分析解答.
解答 解:A、元素的金属性:K>Na>Al>Li,所以离子的氧化性:Li+>Al3+>Na+>K+,故A错误;
B、元素的非金属性:F>Cl>Br>I,所以单质的氧化性:F2>Cl2>Br2>I2,故B正确;
C、元素的非金属性:F>Cl>Br>I,对应的阴离子具有的还原性增强,故C错误;
D、金属具有还原性,故D错误;
故选B.
点评 本题考查学生元素周期律的有关知识,要求学生熟记教材知识,灵活运用.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.现有A、B、C、D、E五种可溶强电解质,它们在水中可电离产生下列离子(各种离子不重复).
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性.②向E溶液中逐滴滴加B溶液至过量,沉淀量先增加后减少但不消失.③D溶液与另外四种溶液反应都能产生沉淀.
试回答下列问题:
(1)A溶液呈碱性的原因是CO32-+H2O?HCO3-+OH-(用离子方程式表示).
(2)写出E溶液与过量的B溶液反应的离子方程式2Al3++3SO42-+3Ba2++8OH-═2AlO2-+4H2O+3BaSO4↓.
(3)若25°时C、E溶液pH=4,则E溶液中水电离出的氢离子浓度是C溶液中水电离出的氢离子浓度106倍.
(4)将C溶液逐滴加入等体积、等物质的量的浓度的A溶液中,反应后溶液中一价离子(+1或-1)浓度由大到小的顺序为:c(Na+)>c(C1-)>c(HCO3-)>c(OH-)>c(H+).
| 阳离子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、NO3-、SO42- |
试回答下列问题:
(1)A溶液呈碱性的原因是CO32-+H2O?HCO3-+OH-(用离子方程式表示).
(2)写出E溶液与过量的B溶液反应的离子方程式2Al3++3SO42-+3Ba2++8OH-═2AlO2-+4H2O+3BaSO4↓.
(3)若25°时C、E溶液pH=4,则E溶液中水电离出的氢离子浓度是C溶液中水电离出的氢离子浓度106倍.
(4)将C溶液逐滴加入等体积、等物质的量的浓度的A溶液中,反应后溶液中一价离子(+1或-1)浓度由大到小的顺序为:c(Na+)>c(C1-)>c(HCO3-)>c(OH-)>c(H+).
4.萜类物质中有许都已被用于香料工业.常见的有如下几种结构(括号内表示④的结构简式):

关于上述四种香料,下列说法正确的是( )

关于上述四种香料,下列说法正确的是( )
| A. | ②和③均属于烯烃类 | B. | ①和③互为同分异构体 | ||
| C. | ④是②的氧化产物 | D. | ③和④均能发生消去、酯化反应 |
1.人类为了维持生命和健康,需要摄取多种食物.
(1)下列食物中富含糖类的是A(填序号).

(2)运动饮料中常含有钠、钾、钙等元素,饮用这种饮料能为人体提供水和无机盐填(营养素名称).
(3)当人体内缺少钙时,可能患有的疾病是AC(填序号).
A.骨质疏松 B.夜盲症 C.佝偻病 D.坏血病
(4)X是合成维生素A的原料.物质甲和乙在一定条件下反应可生成物质丙和X,甲、乙和丙的微观示意图见下表.
①X属于化合物(填“单质”或“化合物”).
②该反应中甲、乙、丙的质量比为23:17:1,则X中各元素的质量比为m(Na):m(N):m(H)=23:14:2.
(1)下列食物中富含糖类的是A(填序号).

(2)运动饮料中常含有钠、钾、钙等元素,饮用这种饮料能为人体提供水和无机盐填(营养素名称).
(3)当人体内缺少钙时,可能患有的疾病是AC(填序号).
A.骨质疏松 B.夜盲症 C.佝偻病 D.坏血病
(4)X是合成维生素A的原料.物质甲和乙在一定条件下反应可生成物质丙和X,甲、乙和丙的微观示意图见下表.
| 物质 | 甲 | 乙 | 丙 |  |
| 微观示意图 |  |  |  |
②该反应中甲、乙、丙的质量比为23:17:1,则X中各元素的质量比为m(Na):m(N):m(H)=23:14:2.
8.下列化学用语表达正确的是( )
| A. | 环已烷的结构简式 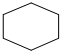 | B. | C2H4的球棍模型 | ||
| C. | 四氯化碳的电子式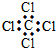 | D. | 苯的分子式 |
5.下列热化学方程式或离子方程式中,正确的是( )
| A. | 甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1 | |
| B. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)$\frac{\underline{\;\;\;\;\;催化剂\;\;\;\;\;}}{500℃30MPa}$ 2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 氯化镁溶液与氨水反应:Mg2++2OH-═Mg(OH)2↓ | |
| D. | 氧化铝溶于NaOH溶液:Al2O3+2OH-+3H2O═2Al(OH)3 |
 .
.