题目内容
16.某单烯烃与氢气的加成产物为:(CH3 )2CHCH2CH3,下列相关说法正确的是( )| A. | 该产物的名称是1,1-二甲基丙烷 | |
| B. | 1mol加成产物燃烧消耗6.5mol氧气 | |
| C. | 原单烯烃只可能有3种不同结构 | |
| D. | 原烯烃与分子式是C3H6的烃一定互为同系物 |
分析 A.根据烷烃命名方法,主链应该是丁烷,不是丙烷;
B.该产物的分子式为C5H12,燃烧生成水和二氧化碳,根据氧原子守恒计算;
C.每两个相邻的碳原子各去掉一个氢原子,共有3种情况;
D.C3H6 不一定是烯烃,有可能是环丙烷.
解答 解:A.(CH3 )2CHCH2CH3的主链应该是丁烷,2号碳上有一甲基,正确命名为 2-甲基丁烷,故A错误;
B.1molH消耗0.5molO,即0.25molO2;1molC消耗1molO2,故1molC5H12,燃烧消耗1×5+0.25×12=8(mol),故B错误;
C.采用逆向分析法,相邻的碳原子各去掉一个氢原子,有三种结果,故有3种不同的烯烃CH2=CH(CH3 )CH2CH3、(CH3 )2C=CHCH3、(CH3 )2CHCH=CH2,故C正确;
D.C3H6有两种结构,一种是丙烯,还一种是环丙烷,故不一定是烯烃,故D错误;
故选C.
点评 本题考查烷烃的命名、同系物判断、有机物燃烧、同分异构体等知识,涉及知识点较多,注意把握概念的内涵与外延,题目难度不大.

练习册系列答案
相关题目
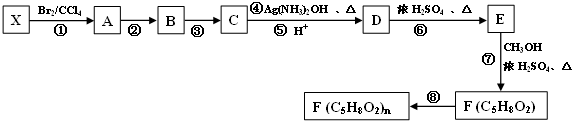
6.已知分子式为C10H14的有机物,该有机物不能与溴水发生加成反应,分子中只有一个烷基,此烷基的结构有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
7.下列反应的离子方程式书写不正确的是( )
| A. | 钠和冷水反应:2Na+2H2O=2Na++2OH-+H2↑ | |
| B. | 氧化亚铁溶于盐酸:FeO+2H+=Fe2++H2O | |
| C. | FeCl2溶液与Cl2反应:2Fe2++Cl2=2Fe3++2Cl- | |
| D. | 碳酸钠溶液与石灰乳的反应:CO32-+Ca2+=CaCO3↓ |
11.下列关于纯净物、混合物、强电解质、弱电解质的正确组合是( )
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 纯盐酸 | 水煤气 | 硫酸 | 醋酸 | 干冰 |
| B | 冰醋酸 | 福尔马林 | 硫酸钡 | 亚硫酸 | 二氧化硫 |
| C | 油酯 | 淀粉 | 苛性钾 | 氢硫酸 | 碳酸钙 |
| D | 重水 | 纤维素 | 氯化钠 | 次氯酸 | 氯气 |
| A. | A | B. | B | C. | C | D. | D |
1. “低碳生活”不只是一种理想,更是一种值得期待的新的生活方式.
“低碳生活”不只是一种理想,更是一种值得期待的新的生活方式.
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ/mol
C(石墨)+CO2(g)═2CO(g)△H2=+172.5kJ/mol;则CO还原Fe2O3的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ•mol-1;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO.PdCl2被还原成单质,反应的化学方程式为PdCl2+CO+H2O=Pd+CO2+2HCl;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2,构成丙烷燃料电池.
①负极电极反应式是:C3H8 +26OH--20e-=3CO32-+17H2O;
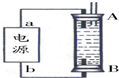
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是ABD(填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-=H2↑
(3)在一定温度下,氧化铁可以与一氧化碳发生反应:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g).已知该反应在不同温度下的平衡常数如表:
①该反应的平衡常数表达式K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$,△H<0(填“>”、“<”或“=”).
②在一个容积为10L的密闭容器中,1 000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)=0.006mol•L-1,CO的平衡转化率为60%.
③欲提高②中CO的平衡转化率,可采取的措施是C.
A.减少Fe的量 B.增加Fe2O3的量 C.移出部分CO2 D.提高反应温度 E.减小容器的容积 F.加入合适的催化剂
(4)将2.4g碳在足量氧气中燃烧,所得气体通入100mL 3.0mol/L的氢氧化钠溶液中,完全吸收后,溶液中所含离子的物质的量浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
 “低碳生活”不只是一种理想,更是一种值得期待的新的生活方式.
“低碳生活”不只是一种理想,更是一种值得期待的新的生活方式.(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ/mol
C(石墨)+CO2(g)═2CO(g)△H2=+172.5kJ/mol;则CO还原Fe2O3的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ•mol-1;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO.PdCl2被还原成单质,反应的化学方程式为PdCl2+CO+H2O=Pd+CO2+2HCl;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2,构成丙烷燃料电池.
①负极电极反应式是:C3H8 +26OH--20e-=3CO32-+17H2O;
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是ABD(填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-=H2↑
(3)在一定温度下,氧化铁可以与一氧化碳发生反应:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g).已知该反应在不同温度下的平衡常数如表:
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
②在一个容积为10L的密闭容器中,1 000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)=0.006mol•L-1,CO的平衡转化率为60%.
③欲提高②中CO的平衡转化率,可采取的措施是C.
A.减少Fe的量 B.增加Fe2O3的量 C.移出部分CO2 D.提高反应温度 E.减小容器的容积 F.加入合适的催化剂
(4)将2.4g碳在足量氧气中燃烧,所得气体通入100mL 3.0mol/L的氢氧化钠溶液中,完全吸收后,溶液中所含离子的物质的量浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
8.根据原子结构及元素周期律的知识,下列推断正确的是( )
| A. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 | |
| B. | ${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl得电子能力相同 | |
| C. | Cl-、S2-、Ca2+、K+半径逐渐减小 | |
| D. | 核外电子排布相同的微粒化学性质也相同 |
6.阿伏加德罗常数约为6.02×1023mol-1,下列说法正确的是( )
| A. | 标准状况下22.4 L NO与11.2 L O2混合后所得气体分子数为6.02×1023 | |
| B. | 标准状况下3.36 L CCl4含碳原子数为0.15×6.02×1023 | |
| C. | 1 mol甲基(-CH3)中所含电子数为9×6.02×1023 | |
| D. | 2 L 1 mol•L-1 的盐酸中所含氯化氢分子数为2×6.02×1023 |
 $\stackrel{[O]}{→}$
$\stackrel{[O]}{→}$ ,
,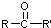 不易被氧化成羧酸
不易被氧化成羧酸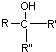 不易被氧化成醛或酮
不易被氧化成醛或酮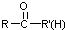 $\stackrel{HCN}{→}$
$\stackrel{HCN}{→}$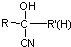 $\stackrel{H^{+}/H_{2}O}{→}$
$\stackrel{H^{+}/H_{2}O}{→}$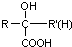 (R、R′、R″均代表烃基 )
(R、R′、R″均代表烃基 )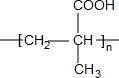 ;
; ;
; ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题: ,这样排布遵循了能量最低、泡利原理和洪特规则.
,这样排布遵循了能量最低、泡利原理和洪特规则.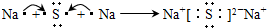 .
.