题目内容
9.卤代烃Y的相对分子质量为92.5,取0.1molY与足量NaOH溶液共热后,再稀HNO3酸化,加入足量AgNO3溶液,得白色沉淀14.35g,则Y与NaOH的乙醇溶液共热,反应后生成的不饱和烃有( )种.| A. | 5种 | B. | 4种 | C. | 3种 | D. | 2种 |
分析 先根据反应生成白色沉淀判断该卤代烃为氯代烃,再结合Y的相对分子质量利用商余法确定其分子式;氯代烃发生消去反应生成烯烃,直接根据烯烃的同分异构体数目进行解答即可.
解答 解:最终得到白色沉淀,该白色沉淀为AgCl,则该卤代烃为氯代烃,生成的氯化银的物质的量为:$\frac{14.35g}{143.5g/mol}$=0.1mol,
Y中含有Cl原子数为:$\frac{0.1mol}{0.1mol}$=1,卤代烃Y的相对分子质量为92.5,则Y中C、H总原子量为:92.5-35.5=57,
利用商余法可得:$\frac{57}{14}$=4…1,则Y的分子式为:C4H9Cl,
Y在氢氧化钠的醇溶液中加热发生消去反应生成丁烯,丁烯的同分异构体有:CH3CH2CH=CH2、CH3CH=CHCH3、CH3C(CH3)=CH2,
所以Y与NaOH的乙醇溶液共热,反应后生成的不饱和烃有3种,
故选C.
点评 本题考查了有机物分子式的确定、同分异构体的书写,题目难度中等,根据题干信息正确推断Y的分子式为解答关键,注意掌握同分异构体的概念及书写原则.

练习册系列答案
相关题目
19.某课题组通过实验探究外界条件变化对化学反应速率产生的影响.
【实验设计】以2NO+2CO$\stackrel{催化剂}{?}$2C02+N2为研究对象,
【图象分析与结论】测定了三组实验中CO浓度随时间变化的曲线图如图:
请回答下列问题
(1)完成【实验设计】(表中不要留空格)
(2)计算第Ⅱ族实验中,反应达平衡时NO的浓度为2.50×10-3mol/L
(3)实验结论:由曲线Ⅰ、Ⅱ可知:增大催化剂比表面积,该反应速率加快,由曲线Ⅰ、Ⅲ可知,升高温度,加快反应速率
(4)升高温度,该反应中NO的转化率减小(填“增大”、“减小”或“无影响”)
【实验设计】以2NO+2CO$\stackrel{催化剂}{?}$2C02+N2为研究对象,
| 实验编号 | 实验目的 | T/℃ | NO初始浓度mol/L | CO初始浓度mol/L | 同种催化剂的比表面积m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 |
| Ⅱ | 6.50×10-3 | 4.00×10-3 | 120 | ||
| Ⅲ | 探究温度对反应速率的影响 | 360 | 80 |

请回答下列问题
(1)完成【实验设计】(表中不要留空格)
(2)计算第Ⅱ族实验中,反应达平衡时NO的浓度为2.50×10-3mol/L
(3)实验结论:由曲线Ⅰ、Ⅱ可知:增大催化剂比表面积,该反应速率加快,由曲线Ⅰ、Ⅲ可知,升高温度,加快反应速率
(4)升高温度,该反应中NO的转化率减小(填“增大”、“减小”或“无影响”)
20.NA代表阿伏伽德罗常数的数值,下列说法中正确的是( )
| A. | 1mol铁完全反应,一定失去2NA个电子 | |
| B. | 1mol任何物质都约含6.02×1023个分子 | |
| C. | 等物质的量的NO和NO2含的N原子数均为1mol | |
| D. | 标况下,22.4L氦气所含的原子总数为NA |
17.下列有关说法错误的是( )
| A. | 油脂的种类很多,但它们水解后都一定有一产物相同 | |
| B. | 淀粉、纤维素都属糖类,它们通式相同,但它们不互为同分异构体 | |
| C. | 甲苯与氯气在光照下反应主要生成2,4-二氯甲苯 | |
| D. | 只用新制的Cu(OH)2悬浊液可以鉴别乙酸溶液、葡萄糖溶液和淀粉溶液 |
14.2008年北京奥运会“祥云”火炬用的是环保型燃料--丙烷(C3H8),悉尼奥运会火炬所用燃料为65%丁烷(C4H10)和35%丙烷,下列有关说法正确的是( )
| A. | 符合通式CnH2n+2的均属于烷烃 | B. | 丙烷分子中所有原子共平面 | ||
| C. | 丁烷的一氯代物有5种 | D. | 以上说法均不正确 |
1. “低碳生活”不只是一种理想,更是一种值得期待的新的生活方式.
“低碳生活”不只是一种理想,更是一种值得期待的新的生活方式.
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ/mol
C(石墨)+CO2(g)═2CO(g)△H2=+172.5kJ/mol;则CO还原Fe2O3的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ•mol-1;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO.PdCl2被还原成单质,反应的化学方程式为PdCl2+CO+H2O=Pd+CO2+2HCl;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2,构成丙烷燃料电池.
①负极电极反应式是:C3H8 +26OH--20e-=3CO32-+17H2O;
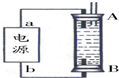
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是ABD(填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-=H2↑
(3)在一定温度下,氧化铁可以与一氧化碳发生反应:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g).已知该反应在不同温度下的平衡常数如表:
①该反应的平衡常数表达式K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$,△H<0(填“>”、“<”或“=”).
②在一个容积为10L的密闭容器中,1 000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)=0.006mol•L-1,CO的平衡转化率为60%.
③欲提高②中CO的平衡转化率,可采取的措施是C.
A.减少Fe的量 B.增加Fe2O3的量 C.移出部分CO2 D.提高反应温度 E.减小容器的容积 F.加入合适的催化剂
(4)将2.4g碳在足量氧气中燃烧,所得气体通入100mL 3.0mol/L的氢氧化钠溶液中,完全吸收后,溶液中所含离子的物质的量浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
 “低碳生活”不只是一种理想,更是一种值得期待的新的生活方式.
“低碳生活”不只是一种理想,更是一种值得期待的新的生活方式.(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ/mol
C(石墨)+CO2(g)═2CO(g)△H2=+172.5kJ/mol;则CO还原Fe2O3的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ•mol-1;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO.PdCl2被还原成单质,反应的化学方程式为PdCl2+CO+H2O=Pd+CO2+2HCl;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2,构成丙烷燃料电池.
①负极电极反应式是:C3H8 +26OH--20e-=3CO32-+17H2O;
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是ABD(填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-=H2↑
(3)在一定温度下,氧化铁可以与一氧化碳发生反应:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g).已知该反应在不同温度下的平衡常数如表:
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
②在一个容积为10L的密闭容器中,1 000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)=0.006mol•L-1,CO的平衡转化率为60%.
③欲提高②中CO的平衡转化率,可采取的措施是C.
A.减少Fe的量 B.增加Fe2O3的量 C.移出部分CO2 D.提高反应温度 E.减小容器的容积 F.加入合适的催化剂
(4)将2.4g碳在足量氧气中燃烧,所得气体通入100mL 3.0mol/L的氢氧化钠溶液中,完全吸收后,溶液中所含离子的物质的量浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
18.下列各组物质的晶体中,化学键类型相同,晶体类型也相同的是( )
| A. | CCl4和PCl3 | B. | NaCl和HCl | C. | CO2和SiO2 | D. | NaH和Na2O2 |
 $\stackrel{[O]}{→}$
$\stackrel{[O]}{→}$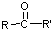 ,
,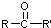 不易被氧化成羧酸
不易被氧化成羧酸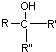 不易被氧化成醛或酮
不易被氧化成醛或酮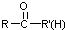 $\stackrel{HCN}{→}$
$\stackrel{HCN}{→}$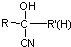 $\stackrel{H^{+}/H_{2}O}{→}$
$\stackrel{H^{+}/H_{2}O}{→}$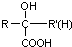 (R、R′、R″均代表烃基 )
(R、R′、R″均代表烃基 )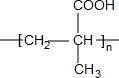 ;
; ;
; ,五种元素原子半径从大到小的顺序是Na、Si、O、F、H(填元素符号);
,五种元素原子半径从大到小的顺序是Na、Si、O、F、H(填元素符号); ,ED4的电子式是
,ED4的电子式是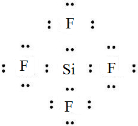 ;
;