题目内容
11.已知aAn+、bB(n+1)+、cCn-、dD(n+1)-均具有相同的电子层结构,关于A、B、C、D四种元素的叙述正确的是( )| A. | 原子半径:A>B>C>D | B. | 原子序数:b>a>c>d | ||
| C. | 离子半径:D>C>B>A | D. | 金属性:B>A,非金属性:D>C |
分析 已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,则有:a-n=b-(n+1)=c+n=d+(n+1),则有A、B在周期表中C、D的下一周期,并且原子序数:b>a>c>d,由离子所带电荷,可知A、B属于金属元素,C、D属于非金属性元素,结合元素周期律递变规律解答该题.
解答 解:已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,则有:a-n=b-(n+1)=c+n=d+(n+1),则有A、B在周期表中C、D的下一周期,并且原子序数:b>a>c>d,由离子所带电荷,可知A、B属于金属元素,C、D属于非金属性元素,则:
A.A、B在周期表中C、D的下一周期,并且原子序数:b>a>c>d,原子核外电子层数越多,原子半径越大,同周期元素原子序数越大,原子半径越小,则有原子半径:A>B>D>C,故A错误;
B.已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,则有:a-n=b-(n+1)=c+n=d+(n+1),则有原子序数:b>a>c>d,故B正确;
C.aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,核电荷数越大离子半径越小,核电荷数b>a>c>d,故离子半径dD(n+1)->cCn->aAn+>bB(n+1),故C错误;
D.A、B在周期表中同周期,原子序数:b>a,则金属性:A>B,C、D在同一周期,且原子序数C>D,则非金属性:C>D,故D错误,
故选B.
点评 本题考查位置结构性质关系及应用,关键是根据核外电子排布确定元素所在周期表中的相对位置,注意对元素周期律的理解掌握,难度不大.

练习册系列答案
相关题目
2.短周期元素形成的离子X2-与Y+都与Ne原子具有相同的电子层结构,则下列叙述中正确的是( )
| A. | 原子序数X>Y | B. | 原子半径X<Y | ||
| C. | X和Y一定同周期 | D. | X是第ⅡA族元素,Y是第VⅡA族元素 |
19.某课题组通过实验探究外界条件变化对化学反应速率产生的影响.
【实验设计】以2NO+2CO$\stackrel{催化剂}{?}$2C02+N2为研究对象,
【图象分析与结论】测定了三组实验中CO浓度随时间变化的曲线图如图:
请回答下列问题
(1)完成【实验设计】(表中不要留空格)
(2)计算第Ⅱ族实验中,反应达平衡时NO的浓度为2.50×10-3mol/L
(3)实验结论:由曲线Ⅰ、Ⅱ可知:增大催化剂比表面积,该反应速率加快,由曲线Ⅰ、Ⅲ可知,升高温度,加快反应速率
(4)升高温度,该反应中NO的转化率减小(填“增大”、“减小”或“无影响”)
【实验设计】以2NO+2CO$\stackrel{催化剂}{?}$2C02+N2为研究对象,
| 实验编号 | 实验目的 | T/℃ | NO初始浓度mol/L | CO初始浓度mol/L | 同种催化剂的比表面积m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 |
| Ⅱ | 6.50×10-3 | 4.00×10-3 | 120 | ||
| Ⅲ | 探究温度对反应速率的影响 | 360 | 80 |

请回答下列问题
(1)完成【实验设计】(表中不要留空格)
(2)计算第Ⅱ族实验中,反应达平衡时NO的浓度为2.50×10-3mol/L
(3)实验结论:由曲线Ⅰ、Ⅱ可知:增大催化剂比表面积,该反应速率加快,由曲线Ⅰ、Ⅲ可知,升高温度,加快反应速率
(4)升高温度,该反应中NO的转化率减小(填“增大”、“减小”或“无影响”)
6.已知分子式为C10H14的有机物,该有机物不能与溴水发生加成反应,分子中只有一个烷基,此烷基的结构有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
16.已知戊烷有3种同分异构体,可以被催化氧化成醛的戊醇的同分异构体(属醇类)的数目有( )
| A. | 4种 | B. | 5种 | C. | 7种 | D. | 8种 |
3.A、B、C、D为中学化学中常见的烃的含氧衍生物,他们有如图的转化关系:则下列判断正确的是( )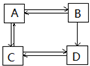

| A. | A的相对分子质量小于C、D的相对分子质量而大于B的相对分子质量 | |
| B. | 若A为2-丙醇,则其可实现如右图的所有转化 | |
| C. | 若A、B、D、为链状化合物,则C也一定为链状化合物 | |
| D. | C→A的反应类型为加成反应 |
20.NA代表阿伏伽德罗常数的数值,下列说法中正确的是( )
| A. | 1mol铁完全反应,一定失去2NA个电子 | |
| B. | 1mol任何物质都约含6.02×1023个分子 | |
| C. | 等物质的量的NO和NO2含的N原子数均为1mol | |
| D. | 标况下,22.4L氦气所含的原子总数为NA |
1. “低碳生活”不只是一种理想,更是一种值得期待的新的生活方式.
“低碳生活”不只是一种理想,更是一种值得期待的新的生活方式.
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ/mol
C(石墨)+CO2(g)═2CO(g)△H2=+172.5kJ/mol;则CO还原Fe2O3的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ•mol-1;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO.PdCl2被还原成单质,反应的化学方程式为PdCl2+CO+H2O=Pd+CO2+2HCl;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2,构成丙烷燃料电池.
①负极电极反应式是:C3H8 +26OH--20e-=3CO32-+17H2O;
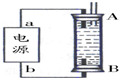
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是ABD(填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-=H2↑
(3)在一定温度下,氧化铁可以与一氧化碳发生反应:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g).已知该反应在不同温度下的平衡常数如表:
①该反应的平衡常数表达式K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$,△H<0(填“>”、“<”或“=”).
②在一个容积为10L的密闭容器中,1 000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)=0.006mol•L-1,CO的平衡转化率为60%.
③欲提高②中CO的平衡转化率,可采取的措施是C.
A.减少Fe的量 B.增加Fe2O3的量 C.移出部分CO2 D.提高反应温度 E.减小容器的容积 F.加入合适的催化剂
(4)将2.4g碳在足量氧气中燃烧,所得气体通入100mL 3.0mol/L的氢氧化钠溶液中,完全吸收后,溶液中所含离子的物质的量浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
 “低碳生活”不只是一种理想,更是一种值得期待的新的生活方式.
“低碳生活”不只是一种理想,更是一种值得期待的新的生活方式.(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ/mol
C(石墨)+CO2(g)═2CO(g)△H2=+172.5kJ/mol;则CO还原Fe2O3的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ•mol-1;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO.PdCl2被还原成单质,反应的化学方程式为PdCl2+CO+H2O=Pd+CO2+2HCl;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2,构成丙烷燃料电池.
①负极电极反应式是:C3H8 +26OH--20e-=3CO32-+17H2O;
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是ABD(填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-=H2↑
(3)在一定温度下,氧化铁可以与一氧化碳发生反应:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g).已知该反应在不同温度下的平衡常数如表:
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
②在一个容积为10L的密闭容器中,1 000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)=0.006mol•L-1,CO的平衡转化率为60%.
③欲提高②中CO的平衡转化率,可采取的措施是C.
A.减少Fe的量 B.增加Fe2O3的量 C.移出部分CO2 D.提高反应温度 E.减小容器的容积 F.加入合适的催化剂
(4)将2.4g碳在足量氧气中燃烧,所得气体通入100mL 3.0mol/L的氢氧化钠溶液中,完全吸收后,溶液中所含离子的物质的量浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).