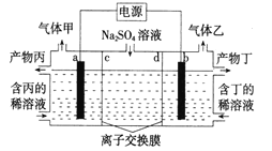
题目内容
【题目】用铜片、银片设计成如图所示的原电池。以下有关该原电池的叙述正确的是 ( )
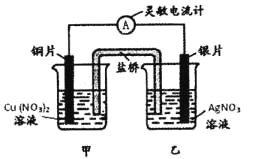
A.电子通过盐桥从乙池流向甲池
B.铜导线替换盐桥,原电池仍继续工作
C.开始时,银片上发生的反应是:Ag—e=Ag+
D.将铜片浸入AgNO3溶液中发生的化学反应与该原电池总反应相同
【答案】D
【解析】
A.原电池负极铜失电子,正极银得电子,电子从负极沿导线流向正极,电解质溶液通过离子的定向移动形成电流,所以电子不经过电解质溶液,故A错误;
B.铜线代替盐桥,乙池是原电池,甲池是电解池发生电镀,所以不是原来的装置反应原理,故B错误;
C.银片是原电池的正极,溶液中的银离子得到电子发生还原反应,电极反应是Ag++e-=Ag,故C错误;
D.铜片浸入AgNO3溶液中发生的化学反应与该原电池总反应都是发生了Cu+2Ag+=2Ag+Cu2+;故D正确;
故选D。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
【题目】25 ℃时,几种弱酸的电离常数如下:
弱酸的化学式 | CH3COOH | HCN | H2S |
电离常数(25 ℃) | 1.8×10-5 | 4.9×10-10 | K1=1.3×10-7 K2=7.1×10-15 |
25 ℃时,下列说法正确的是
A.等物质的量浓度的各溶液的pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN)
B.a mol/L HCN溶液与b mol/L NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定大于b
C.NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
D.某浓度的HCN溶液的pH=d,则其中c(OH-)=10-d mol/L