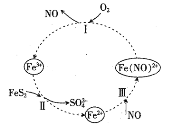
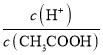题目内容
【题目】电解Na2SO4溶液联合生产硫酸和烧碱溶液的装置如下图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1:2。下列说法正确的是( )
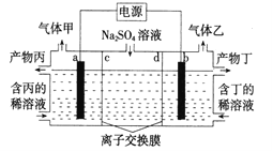
A.b 极与电源的正极相连
B.产物丙为NaOH 溶液
C.离子交换膜d 为阴离了交换膜(允许阴离子通过)
D.a 电极反应式为2H2O-4e-=4H++O2↑
【答案】D
【解析】
装置图分析可知是电解装置,电极硫酸钠溶液,实质是电解水,气体甲与气体乙的体积比约为1:2,气体甲为O2,气体乙为H2,阳极生成O2,电极反应2H2O-4e-=4H++O2↑,阴极生成H2,2H++2e-= H2↑,气体体积比为1:2,所以判断a电极是阳极,b电极是阴极,在阳极室得到硫酸,在阴极室得到氢氧化钠,则c为阴离子交换膜,d为阳离子交换膜。
A.由上述分析可知:a电极为阳极,与电源正极相连,A错误;
B.阳极a生成O2,电极反应2H2O-4e-=4H++O2↑,阳极室水的电离平衡被破坏生成H+,生成产物丙为硫酸,阴极生成氢气,2H++2e-=H2↑,生成产物丁为NaOH,B错误;
C.阳极a生成O2,电极反应2H2O-4e-=4H++O2↑,阳极室水的电离平衡被破坏生成氢离子,生成产物丙为硫酸,阴极生成H2,2H++2e-=H2↑,生成产物丁为氢氧化钠,则c为阴离子交换膜,d为阳离子交换膜,C错误;
D.阳极a生成O2,电极反应2H2O-4e-=4H++O2↑,D正确;
故合理选项是D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目