题目内容
【题目】设![]() 代表阿伏加德罗常数的值,下列有关说法正确的是
代表阿伏加德罗常数的值,下列有关说法正确的是![]()
![]()
A.![]() 冰醋酸晶体中,含阴离子数目为
冰醋酸晶体中,含阴离子数目为![]()
B.标准状况下,![]() 中含有分子的数目为
中含有分子的数目为![]()
C.常温下,![]() 与
与![]() 混合气体中含分子数为
混合气体中含分子数为![]()
D.![]() 投入
投入![]() 的浓硝酸中,充分反应后转移电子数为
的浓硝酸中,充分反应后转移电子数为![]()
【答案】D
【解析】
A.冰醋酸晶体只有分子没有阴离子,故A错误;
B.标况下![]() 是液体,无法根据气体摩尔体积计算22.4LCCl4物质的量,故B错误;
是液体,无法根据气体摩尔体积计算22.4LCCl4物质的量,故B错误;
C.若全为NO2,物质的量为![]() =1mol,若全为N2O4,物质的量为
=1mol,若全为N2O4,物质的量为![]() =0.5mol,实际为混合气体,且存在2NO2N2O4,则46g的NO2和N2O4混合气体含有的分子数小于NA,故C错误;
=0.5mol,实际为混合气体,且存在2NO2N2O4,则46g的NO2和N2O4混合气体含有的分子数小于NA,故C错误;
D.![]() n=
n=![]() =
=![]() =
=![]() 的浓硝酸含有硝酸3mol,根据铜与硝酸反应的方程式可知,Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,硝酸过量,铜全部反应,铜的化合价从0价升高到+2价,则充分反应后转移的电子
的浓硝酸含有硝酸3mol,根据铜与硝酸反应的方程式可知,Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,硝酸过量,铜全部反应,铜的化合价从0价升高到+2价,则充分反应后转移的电子![]() ,即为
,即为![]() ,故D正确;
,故D正确;
答案选D。

【题目】日常生活中,汽车尾气中排放的NOx和CO污染环境,在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。
已知:①2CO(g)+O2(g) ![]() 2CO2(g) ΔH= -akJ/mol
2CO2(g) ΔH= -akJ/mol
②N2(g)+O2(g) ![]() 2NO(g) ΔH= +bkJ/mol
2NO(g) ΔH= +bkJ/mol
③2NO(g)+O2(g) ![]() 2NO2(g) ΔH= -ckJ/mol
2NO2(g) ΔH= -ckJ/mol
回答下列问题:
(1)CO的燃烧热为____________________。
(2)CO将NO2还原为单质的热化学方程式为_____________________________。
(3)为了模拟反应2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如下表:
N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(10-4mol/L) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(10-3mol/L) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前2s内的平均反应速率V(N2)=_________________________________。
②能说明上述反应达到平衡状态的是_______________。
A.2n(CO2)=n(N2)
B.混合气体的平均相对分子质量不变
C.气体密度不变
D.容器内气体压强不变
③当NO与CO浓度相等时,体系中NO的平衡转化率与温度、压强的关系如图所示。
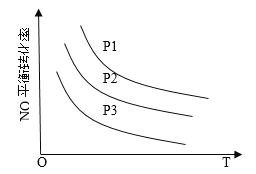
则NO的平衡转化率随温度升高而减小的原因是______________________________
图中压强(P1、P2、P3)的大小顺序为_____________________。