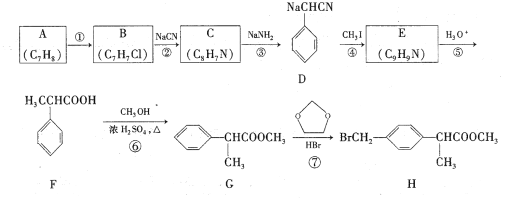
题目内容
【题目】硫氰酸盐在化学工业中应用广泛。
(1)组成硫氰酸根(SCN -)的三种元素的部分性质见下表:
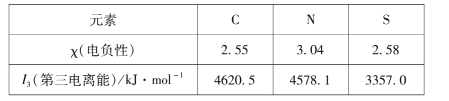
①硫氰酸根中碳元素的化合价为____。
②碳元素的I1、I2均比氮小。但I3却比氮高,其原因是____。
(2)晶体场理论认为,基态离子的d轨道存在未成对电子时,d电子发生d-d跃迁是金属阳离子在水溶液中显色的主要原因。下列硫氰酸盐的水溶液有颜色的是____(填标号)。
A KSCN B Fe(SCN)3 C Ni(SCN)2 D Zn(SCN)2
(3)NH4SCN广泛应用于医药、印染等行业,隔绝空气加热后可分解生成NH3、CS2、H2S、(CN)2及N2。
①SCN-可能具有[S-C≡N]-和____(填结构式)两种结构,中心原子碳的轨道杂化方式均为____。
②(CN)2熔沸点高于N2的原因是____。
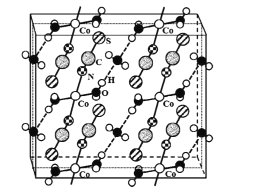
(4)硫氰酸钴可用于毒品检验。其水合物晶体的晶胞结构如下图所示(所有原子都不在晶胞的顶点或棱上)。
①晶体中微粒间作用力有____(填标号)。
A 金属键 B 氢键 C 非极性键 D 极性键 E 配位键
②晶体的化学式为____。
③硫氰酸钴晶体属于正交晶系,晶胞参数分别为a nm、b nm.c nm,α=β=γ=90°。晶体的摩尔质量为M g·mol-1。则晶体密度=____g·cm-3(列计算式)。
【答案】+4 N2+、C2+的价电子排布分别为2s22p1和2s2,C2+的2p轨道全空,处于较稳定状态,更难失去电子 BC [S=C=N]- sp (CN)2和N2均为非极性分子构成的分子晶体,(CN)2的相对分子质量较大,范德华力较大,熔沸点较高 BDE Co(H2O)2(SCN)2·H2O或Co(SCN)2(H2O)2·H2O或Co(SCN)2·3H2O ![]()
【解析】
(1)①硫氰酸根离子中,中心碳原子的电负性比硫和氮都小,所以碳元素显正价,硫、氮元素显负价,由于碳原子最外层只有四个电子,与氮和硫原子结合时,能形成四对共用电子对,故碳显+4价;
②第三电离能用以衡量R2+失去电子的难易程度,N2+、C2+的价电子排布分别为2s22p1和2s2,C2+的2p轨道全空,处于较稳定状态,更难失去电子,所以其第三电离能更大;
(2)K+的3d轨道全空,Zn2+的3d轨道全充满,无法发生d-d跃迁;Fe3+的3d轨道电子排布为3d5,存在5个未成对电子,Ni2+的3d轨道电子排布式为3d8,存在2个未成对电子,二者可以发生d-d跃迁,其硫氰酸盐的水溶液会有颜色,所以选BC;
(3)①从已知结构[S-C≡N]-中碳原子的成键特点(一个叁键、一个单键)可以判断C原子的杂化方式为sp杂化,中心碳原子以两个sp杂化轨道分别和S、N原子的1个p轨道形成σ键,C原子剩余的两个未杂化的2p轨道以肩并肩的方式与氮原子另外2个p轨道形成2个π键,即中心碳原子形成两个σ键和两个π键;另一种可能的情况是,碳原子剩余的两个未杂化的2p轨道分别与氮原子、硫原子的p轨道形成两个大π键,即两个双键的结构[S=C=N]-;
②(CN)2(直线形对称结构,正负电荷中心重合)和N2都是非极性分子,二者均为分子晶体,其熔、沸点高低取决于范德华力的大小,通常相对分子质量越大,范德华力越大;
(4)①从晶胞结构可以看出,硫氰酸钴晶体是一种带有结晶水的配合物,中心原子是Co2+, SCN-和H2O是配体;H2O除了与Co2+形成配位键以外,还有一部分H2O不做配体,只与作为配体的H2O之间以氢键结合;配体H2O、SCN-中都含有极性键,不含非极性键;金属键通常只存在于金属晶体中;所以选BDE;
②根据晶胞结构可知2个Co2+在晶胞内部,4个Co2+在面上,根据均摊法每个晶胞含有的Co2+个数为2+![]() =4;SCN-全在晶胞内,共8个,配体H2O全在晶胞内的有8个(注意与处于上、下底面的Co2+配位的两个H2O分子,均有一个在晶胞内,一个在晶胞外),未做配体的H2O,2个在晶胞内,4个在面上,平均每个晶胞含有这样的水分子个数为4。由此得出Co2+、SCN-、配体H2O、非配体H2O的个数比为1:2:2:1,则化学式为Co(H2O)2(SCN)2·H2O或Co(SCN)2(H2O)2·H2O或Co(SCN)2·3H2O;
=4;SCN-全在晶胞内,共8个,配体H2O全在晶胞内的有8个(注意与处于上、下底面的Co2+配位的两个H2O分子,均有一个在晶胞内,一个在晶胞外),未做配体的H2O,2个在晶胞内,4个在面上,平均每个晶胞含有这样的水分子个数为4。由此得出Co2+、SCN-、配体H2O、非配体H2O的个数比为1:2:2:1,则化学式为Co(H2O)2(SCN)2·H2O或Co(SCN)2(H2O)2·H2O或Co(SCN)2·3H2O;
③由上题分析可知,每个晶胞中含有4个Co(SCN)2·3H2O粒子集合体,每个粒子集合体的质量为![]() ,则晶胞的质量为
,则晶胞的质量为![]() ,晶胞的体积为abc×10-21cm3,所以晶胞的密度为
,晶胞的体积为abc×10-21cm3,所以晶胞的密度为![]() g/cm3。
g/cm3。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某学习小组通过下列装置探究MnO2与FeCl3·6H2O能否反应产生Cl2。

实验操作和现象:
操 作 | 现 象 |
点燃酒精灯,加热 | ⅰ.A中部分固体溶解,上方出现白雾 ⅱ.稍后,产生黄色气体,管壁附着黄色液滴 ⅲ.B中溶液变蓝 |
(1)现象ⅰ中的白雾是 ,形成白雾的原因是 。
(2)分析现象ⅱ,该小组探究黄色气体的成分,实验如下:
a.加热FeCl3·6H2O,产生白雾和黄色气体。
b.用KSCN溶液检验现象ⅱ和a中的黄色气体,溶液均变红。
通过该实验说明现象ⅱ中黄色气体含有 。
(3)除了氯气可使B中溶液变蓝外,推测还可能的原因是:
① 实验b检出的气体使之变蓝,反应的离子方程式是________________。实验证实推测成立。
② 溶液变蓝的另外一种原因是:在酸性条件下,装置中的空气使之变蓝。通过进一步实验确认了这种可能性,其实验方案是 。
(4)为进一步确认黄色气体是否含有Cl2,小组提出两种方案,均证实了Cl2的存在。
方案1:在A、B间增加盛有某种试剂的洗气瓶C。
方案2:将B中KI-淀粉溶液替换为NaBr溶液;检验Fe2+ 。
现象如下:
方案1 | B中溶液变为蓝色 |
方案2 | B中溶液呈浅橙红色;未检出Fe2+ |
①方案1的C中盛放的试剂是 。
②方案2中检验Fe2+ 的原因是 。
③综合方案1、2的现象,说明选择NaBr溶液的依据是 。
(5)将A中产物分离得到Fe2O3和MnCl2,A中产生Cl2的化学方程式是 。