题目内容
【题目】氧化还原反应原理在生产生活和科学研究中应用广泛。
(1)下列表述中没有氧化还原反应发生的是_____。
a.滴水成冰 b.蜡炬成灰 c.百炼成钢
(2)NH3和Cl2反应的方程式为:NH3+Cl2—N2+HCl
①该反应中被氧化的元素是___(填元素名称),氧化剂是__(填化学式)。
②配平该方程式:____NH3+ ____Cl2—____N2+____HCl
③工业生产中常用喷洒氨水的方法来检查是否有Cl2泄漏,若Cl2有泄漏,可以观察到的现象是______,产生该现象的反应方程式为___。
(3)“地康法”制氯气的反应原理图示如下:
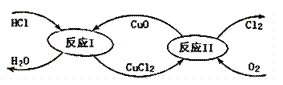
①反应I的化学方程式为____。
②若要制得标准状况下氯气11.2L,则整个反应中转移电子的物质的量为____。
【答案】a 氮 Cl2 2 3 1 6 有白烟产生 HCl+NH3=NH4Cl(3Cl2+8NH3=6NH4Cl+N2) 2HCl+CuO=CuCl2+H2O 1mol
【解析】
(1)化学变化的本质为有新的物质的生成;
(2)根据化合价升降法进行配平;还原剂为升失氧;
(3)①根据图示可知,反应I为非氧化还原反应,无电子转移;反应II为氧化还原反应。
(1)a.滴水成冰,水由液体变为固态,分子式未变,为物理变化,a正确;
b.蜡炬成灰,为含碳化合物的燃烧,为化学变化,b错误;
c.百炼成钢,降低铁中碳的含量,为化学变化,c错误;
答案为a;
(2)①反应中N的化合价由-3价变为0价,Cl的化合价由0价变为-1价,氮原子被氧化,氧化剂为氯气;
②根据化合价升降法,2个氨气分子中的N失去6个电子,3个氯气分子得到6个电子,则系数分别为:2、3、1、6;
③氨气与氯气反应生成氯化铵和氮气,氯化铵为白色固体,观察到有白烟生成,反应方程式为:3Cl2+8NH3=6NH4Cl+N2;
(3)①根据图示可知,反应I中,反应物为HCl、CuO,生成物为水和氯化铜,方程式为2HCl+CuO=CuCl2+H2O;
②反应I为非氧化还原反应,无电子转移;反应II中生成1mol氯气,化合价由-1价变为0价,转移2mol电子,制得标准状况下氯气11.2L,即0.5mol,转移1mol电子;故答案为:1mol。