题目内容
【题目】常温下,在下列各组指定溶液中一定不能大量共存的离子组的个数是( )
①强酸性溶液中:Mg2+、K+、![]() 、
、![]()
②强碱性溶液中:Na+、Ba2+、![]() 、
、![]()
③在无色溶液中:H+、K+、![]() 、F-
、F-
④0.1mol/LBa(NO3)2溶液:Mg2+、K+、![]() 、Cl-
、Cl-
⑤无色透明溶液中:![]() 、K+、Cl-、
、K+、Cl-、![]()
⑥无色透明的碱性溶液中:Na+、Ba2+、Cl-、![]()
A.一个B.两个C.三个D.四个
【答案】C
【解析】
①强酸性溶液中氢离子浓度大于氢氧根离子浓度:Mg2+、K+、SO42-、NO3-四种离子之间不反应,和氢离子之间也不反应,可以大量共存,故①不符合题意;
②强碱性溶液中氢氧根离子浓度大于氢离子浓度:Na+、Ba2+、HCO3-、NO3-中,HCO3-与OH-反应生成CO32-,不能大量共存,故②符合题意;
③在无色溶液中:H+、K+、SO42-、F-中,F-与H+生成氢氟酸,不能大量共存,故③符合题意;
④0.1mol/LBa(NO3)2溶液:Mg2+、K+、SO42-、Cl-中,Ba2+与SO42 –会生成硫酸钡沉淀,在溶液中不能大量共存,故④符合题意;
⑤无色透明溶液中:SO42-、K+、Cl-、NO3-离子间不发生反应,可以大量共存,故⑤不符合题意;
⑥无色透明的碱性溶液中:Na+、Ba2+、NO3-、Cl-离子间不发生化学反应,可以大量共存,故⑥不符合题意;
②③④符合题意,C可选;
答案选C。

【题目】用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
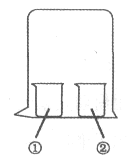
①中的物质 | ②中的物质 | 预测①的现象 | |
A | 淀粉KI溶液 | 浓硝酸 | 无明显变化 |
B | 酚酞溶液 | 浓盐酸 | 无明显变化 |
C | MgCl2溶液 | 浓氨水 | 有白色沉淀 |
D | 湿润红纸条 | 饱和氯水 | 红纸条褪色 |
A. AB. BC. CD. D
【题目】学习小组研究钠的燃烧反应产物,取金属钠(表面已被氧化),吸干煤油,置于坩埚内,上方倒扣盛满O2集气瓶,加热一段时间,充分反应后观察到产物为白色固体和淡黄色固体的混合物,测得反应前后各物质的质量如下表:
质量/g | ||
反应前 | 坩埚 | 100 |
盛有金属钠的坩埚 | 105.4 | |
反应后 | 盛有固体产物的坩埚 | 107.4 |
请回答下列问题:
(1)根据实验现象,推测固体产物成分为___________________(填化学式)
(2)将产物全部溶于水,观察到有气泡生成,写出该反应的化学方程式为________。
(3)测得上述溶液中n(Na+)=0.2mol,通过计算证实加热过程中存在表面的Na2O转化为Na2O2。___________________