题目内容
16.利用金属活动性的不同,可以采用不同的冶炼方法.下面关于金属冶炼叙述正确的是( )| A. | 高炉炼铁采用了热分解法 | |
| B. | 电解氯化钠溶液冶炼金属钠 | |
| C. | 依据Fe+CuSO4═FeSO4+Cu的原理冶炼金属铜 | |
| D. | 金属冶炼的实质是将金属元素从其化合物中氧化出来 |
分析 根据金属的活动性强弱选择合适的冶炼方法,一般来说,活泼金属用电解法,较活泼金属用热还原法,不活泼金属如Hg、Ag等用热分解法冶炼,据此进行分析解答.
解答 解:A.铁性质较活泼,用热还原法冶炼铁,故A错误;
B.钠性质活泼,用电解熔融氯化钠的方法制取钠,故B错误;
C.铜性质活泼可用还原法制取,铁活泼性强于铜,能够置换铜,故C正确;
D.金属冶炼的实质是金属元素由化合态转变成游离态,将金属元素从其化合物中还原出来,故D错误;
故选:C.
点评 本题考查了金属的冶炼,熟悉金属的性质及不同性质金属冶炼方法是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.2molNaOH配成200mL溶液,其物质的量浓度为( )
| A. | 2mol/L | B. | 10 mol/L | C. | 0.2 mol/L | D. | 0.1 mol/L |
11.CuCl2常用于颜料、木材防腐等工业,并用作消毒剂、媒染剂、催化剂.工业上用粗制的氧化铜粉末(含杂质FeO和SiO2)来制取无水CuCl2的流程如下:

已知:Fe3+、Fe2+、Cu2+转化为相应的氢氧化物,开始沉淀和沉淀完全时的pH如下表:
(1)第②步反应的离子方程式为2Fe2++Cl2═2Fe3++2Cl-.
(2)滤渣A的成分有SiO2(填化学式),检验滤液C中的Fe3+离子是否除尽的方法是取滤液C少量于试管中,滴加几滴KSCN溶液,若溶液变为血红色,证明滤液C中的Fe3+离子未除尽,反之已除尽.
(3)第④步蒸发操作必要的仪器有铁架台(含铁圈)、坩埚钳、石棉网、酒精灯、蒸发皿、玻璃棒.需要在氯化氢气流中蒸干制取无水氯化铜的原因是HCl抑制CuCl2水解.
(4)称取30.250g已制得的无水CuCl2产品(含少量FeCl3杂质),溶于水中,加入过量的铁粉充分反应后过滤,得250mL滤液,量取25.00mL滤液于锥形瓶中,用0.100mol?L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液体积平均为46.00mL,则该无水CuCl2产品中CuCl2的质量分数为0.89(用小数表示,计算结果保留2位小数).

已知:Fe3+、Fe2+、Cu2+转化为相应的氢氧化物,开始沉淀和沉淀完全时的pH如下表:
| 离子符号 | Fe3+ | Fe2+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 2.5 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.7 | 6.7 |
(2)滤渣A的成分有SiO2(填化学式),检验滤液C中的Fe3+离子是否除尽的方法是取滤液C少量于试管中,滴加几滴KSCN溶液,若溶液变为血红色,证明滤液C中的Fe3+离子未除尽,反之已除尽.
(3)第④步蒸发操作必要的仪器有铁架台(含铁圈)、坩埚钳、石棉网、酒精灯、蒸发皿、玻璃棒.需要在氯化氢气流中蒸干制取无水氯化铜的原因是HCl抑制CuCl2水解.
(4)称取30.250g已制得的无水CuCl2产品(含少量FeCl3杂质),溶于水中,加入过量的铁粉充分反应后过滤,得250mL滤液,量取25.00mL滤液于锥形瓶中,用0.100mol?L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液体积平均为46.00mL,则该无水CuCl2产品中CuCl2的质量分数为0.89(用小数表示,计算结果保留2位小数).
1.下列叙述不正确的是( )
| A. | 随着碳原子数的增加,烷烃的熔、沸点升高 | |
| B. | 在有机物中,碳原子通过四个共价键与其它原子结合 | |
| C. | 甲烷、乙烯都能使酸性高锰酸钾溶液褪色 | |
| D. | 烷烃在光照下与氯气发生取代反应 |
5.下列关于原电池的说法正确的是( )
| A. | 原电池中的电极一定要由两种不同的金属组成 | |
| B. | 电子流出的一极是正极 | |
| C. | 任何化学反应都能设计成原电池 | |
| D. | 原电池中的阳离子向正极移动 |
6.纤维素可表示为[C6H7O2(OH)3],以下叙述不正确的是( )
| A. | 滴加浓硫酸碳化变黑 | B. | 能与硝酸反应生成纤维素三硝酸酯 | ||
| C. | 能水解生成葡萄糖 | D. | 与淀粉互为同分异构体 |
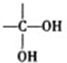 这个结构不稳定,自动脱水,生成碳基.
这个结构不稳定,自动脱水,生成碳基.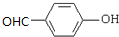 ;有机物C的系统名称为:2-甲基丙醛.
;有机物C的系统名称为:2-甲基丙醛.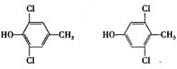 .
.