题目内容
20.我国在酒泉卫星发射中心用“长征二号丁”运载火箭以“一箭多星”的方式,将国家科技重大专项高分辨率对地观测系统首颗卫星“高分一号”成功发射升空,此颗卫星堪称“太空千里眼”,对国土资源调查、环境监测、地理测绘和精准农业及国防工业等将起到十分重要的作用.I、“高分一号”使用了大功率运载火箭,火箭推进器中装有还原剂肼(N2H4)和强氧化剂过氧化氢(H2O2),发生的反应为N2H4(l)+2H2O2(l)═N2(g)+4H2O(g),已知生成1mol H2O(g)放出160.4KJ能量.
(1)H2O2在催化剂作用下分解的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(2)用电子式表示H2O的形成过程
 .
.(3)若该火箭推进器中H2O2有24mol共价键发生断裂,则放出的能量为2566.4KJ.
II、科学家设想利用太阳能电池电解水产生的气体设计成燃料电池给卫星供电,可产生水循环的环保型的卫星供电系统.
(4)将生成的氢气用于燃料电池时,实现了化学能转化为电能;水分解时,断裂的化学键为共价键,分解水的反应属于吸热(填“放热”或“吸热”)反应.
该氢氧燃料电池的电解质溶液为KOH溶液,则电池反应的负极反应为H2-2e-+2OH-=2H2O,电池工作一段时间后,电解质溶液中KOH的物质的量不发生(填“发生”或“不发生”)变化.
分析 (1)过氧化氢在二氧化锰做催化剂的条件下生成水和氧气;
(2)氢原子和氧原子之间以共用电子对而形成水分子;
(3)1mol过氧化氢中3mol的共价键,所以H2O2有24mol共价键发生断裂,反应的过氧化氢为8mol,由2molH2O2生成4molH2O(g),则8mol的过氧化氢生成16mol的水,又因为生成1mol H2O(g)放出160.4KJ能量,所以放出热量为:160.4KJ×16=2566.4KJ;
(4)原电池是将化学能转化为电能的装置,非金属元素之间形成的化学键大多是共价键,物质的分解反应是吸热反应;氢氧燃料电池中,H2从负极通入,在反应中被氧化;根据电极反应确定pH的变化.
解答 解:(1)过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,故答案为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(2)H2O为共价化合物,各原子达到稳定结构,用电子式表示形成过程为 ,
,
故答案为: ;
;
(3)1mol过氧化氢中3mol的共价键,所以H2O2有24mol共价键发生断裂,反应的过氧化氢为8mol,由2molH2O2生成4molH2O(g),则8mol的过氧化氢生成16mol的水,又因为生成1mol H2O(g)放出160.4KJ能量,所以放出热量为:160.4KJ×16=2566.4KJ,故答案为:2566.4KJ;
(4)氢气用于燃料电池,燃料电池是将化学能转化为电能的装置,水分解时,断裂的化学键为H-O键,属于共价键,分解海水的反应属于吸热反应,氢氧燃料电池中,H2从负极通入,负极的电极反应式为:H2-2e-+2OH-=2H2O;负极上氢气和氢氧根离子反应生成水,正极上氧气得电子和水反应生成氢氧根离子,氢氧燃料电池的产物是水,KOH的物质的量不变,溶液的体积增大,浓度变小,所以PH值减小,故答案为:化学;电;共价;吸热;H2-2e-+2OH-=2H2O;不发生.
点评 本题考查化学方程式的书写、用电子式表示物质的形成、热量的转化和电极反应式的书写,综合性强,但比较容易.

| A. | 电子排布式1s22s22p63s23p64s3违反了泡利原理 | |
| B. | 基态原子电子排布式1s22s22p63s23p63d5违反了能量最低原理 | |
| C. | 根据构造原理,原子核外电子填充顺序为1s2s2p3s3p4s3d4p5s5p4d6s4f5d6p | |
| D. | 某主族元素气态基态原子的逐级电离能分别为738、1451、7733、10540、13630、17995、21703…,当它与氯气反应时生成的阳离子是X2+ |
| A. | 吸热反应的发生都需要加热,吸热反应都没有利用价值 | |
| B. | 若某反应正向进行时为放热反应,则该反应逆向进行时必为吸热反应 | |
| C. | 放热反应放出热量的多少与反应物的质量和状态有关 | |
| D. | 不管是吸热反应还是放热反应,升高温度,反应速率均增大 |
| A. | ②①④③ | B. | ③④①② | C. | ③④②① | D. | ①②③④ |
| A. | 氯气是氧化剂,水是还原剂 | B. | 水被还原,氯气被氧化 | ||
| C. | 氯气既是氧化剂,又是还原剂 | D. | 该反应不是氧化还原反应 |
| A. | 电解液的质量增加xg | B. | 阴极质量增加xg | ||
| C. | 阴极质量增加bg,b>x | D. | 阴极质量增加bg,b<x |

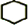 ,名称是环己烷.
,名称是环己烷. +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$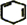 +2NaBr+2H2O.
+2NaBr+2H2O. C2H2
C2H2 NaOH
NaOH .
.