题目内容
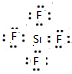
8.写出下列物质的电子式SiF4
 C2H2
C2H2 NaOH
NaOH .
.
分析 SiF4 属于共价化合物,分子中氟原子与四个硅原子之间形成4对共用电子对;
乙炔分子中两个碳原子形成三对共用电子对,碳原子与氢原子之间形成1对共用电子对;
氢氧化钠为离子化合物,电子式中需要标出阴阳离子所带电荷,氢氧根离子需要标出最外层电子;
解答 解:SiF4 属于共价化合物,分子中氟原子与四个硅原子之间形成4对共用电子对,电子式为 ,
,
乙炔分子中两个碳原子形成三对共用电子对,碳原子与氢原子之间形成1对共用电子对,电子式为 ,
,
氢氧化钠属于离子化合物,电子式中需要标出阴阳离子所带电荷,钠离子直接用离子符号表示,氢氧根离子需要标出最外层电子,氢氧化钠的电子式为: ,
,
故答案为: ;
; ;
; .
.
点评 本题考查了电子式的书写,题目难度不大,注意掌握电子式的概念及表示方法,明确离子化合物与共价化合物的电子式的表示方法及区别.

练习册系列答案
相关题目
18.设NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 除去苯中混有的少量苯酚:加入适量浓溴水,振荡、静置后过滤 | |
| B. | 0.5 mol NH4HSO4晶体中,含有H+数目约为0.5 NA | |
| C. | 在0.1 mol•L-1Na2CO3溶液中:c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+) | |
| D. | 检验卤代烃中的卤原子:取足量液体与NaOH溶液共热后,再滴加AgNO3溶液 |
19.下列说法中正确的是( )
| A. | 沸点:PH3>NH3>H2O | |
| B. | CO2分子中的化学键为非极性键 | |
| C. | NH3分子中N原子的杂化轨道类型是sp2 | |
| D. | NH4+为正四面体结构,可推测出PH4+也为正四面体结构 |
1.下列有关物质用途的说法错误的是( )
| A. | 过氧化钠可用作潜艇里氧气的来源 | |
| B. | 金属钠用于生产玻璃 | |
| C. | 乙醇可用作燃料 | |
| D. | 用漂白粉对H7N9禽流感疫区进行环境消毒 |
 ,有机玻璃可按下列路线合成:
,有机玻璃可按下列路线合成:
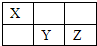 X、Y、Z均为短周期元素,它们在周期表中的相对位置如图所示.已知X、Y、Z三元素的质子数之和为40,请回答:
X、Y、Z均为短周期元素,它们在周期表中的相对位置如图所示.已知X、Y、Z三元素的质子数之和为40,请回答: .
. .
. .
.