题目内容
6.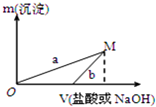 下列两种方案制备氢氧化铝:
下列两种方案制备氢氧化铝:方案一:2.7g Al $\stackrel{100mL稀盐酸}{→}$X溶液 $\stackrel{NaOH溶液}{→}$Al(OH)3沉淀
方案二:2.7g Al $\stackrel{100mLNaOH溶液}{→}$Y溶液$\stackrel{稀盐酸}{→}$Al(OH)3沉淀
已知所用的稀盐酸与NaOH溶液均为3mol/L.图是向X溶液与Y溶液中分别加入NaOH溶液或稀盐酸时产生沉淀的质量与加入溶液体积之间的关系.相关说法正确的是( )
| A. | a曲线表示的是向Y溶液中加入NaOH溶液 | |
| B. | 方案二比方案一生成更多的气体 | |
| C. | 在M点时,两种方案中所得溶液的溶质质量分数相同 | |
| D. | M点以后,a、b两条曲线将重合为一条 |
分析 根据实验方案知,X溶液是氯化铝溶液、Y溶液是偏铝酸钠溶液,
铝的物质的量=$\frac{2.7g}{27g/mol}$=0.1mol,n(HCl)=n(NaOH)=3mol•L-1×0.1L=0.3mol,根据反应:2Al+6HCl=2AlCl3+3H2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑,知酸恰好反应、碱过量,
A.酸恰好和铝反应,所以X溶液中的溶质是氯化铝,向氯化铝溶液中加入氢氧化钠会立即产生沉淀;
B.据得失电子守恒判断判断两种方案生成气体量是否相等;
C.根据原子守恒判断;
D.根据反应:Al(OH)3+3HCl=AlCl3+3H2O,Al(OH)3+NaOH═NaAlO2+2H2O判断.
解答 解:A.通过以上分析知,铝和盐酸恰好反应,所以溶液中的溶质是氯化铝,向氯化铝中加入氢氧化钠溶液,立即产生沉淀,所以a曲线表示的是向X溶液中加入NaOH溶液,故A错误;
B.据得失电子守恒,铝质量相同,方案二和方案一生成氢气的气体也相同,故B错误;
C.在M点时,沉淀达到最大,所得溶液中只有氯化钠溶质,与向X溶液和Y溶液中分别加入NaOH和HCl的浓度及体积相等,根据原子守恒得M点时两方案中所得溶液浓度相等,故C正确;
D.M点时,Al(OH)3量相同,根据反应:Al(OH)3+3HCl=AlCl3+3H2O,Al(OH)3+NaOH═NaAlO2+2H2O,消耗盐酸和氢氧化钠溶液体积不等,所以a、b两条曲线将不能重合为一条,故D错误;
故选C.
点评 本题以物质制备为载体考查化学实验方案评价,为高频考点,明确物质之间反应是解本题关键,知道各曲线表示的物理量,注意结合方程式分析解答,题目难度中等.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
16.能正确表示下列反应的离子方程式是( )
| A. | 将Fe(OH)3加入氢碘酸中:Fe(OH)3+3H+═Fe3++3H20 | |
| B. | 将H2S气体通入到CuS04溶液中:S2-+Cu2+═CuS↓ | |
| C. | 向含l mol FeBr2的溶液中通入l mol Cl2:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| D. | 向Al2(S04)3溶液中加入过量Ba(OH)2溶液,有白色沉淀生成2Al3++3S042-+3Ba2++60H-═2AI(OH)3↓+3BaS04↓ |
11.下列分子中,分子间不能形成氢键的是( )
| A. | NH3 | B. | HF | C. | C2H5OH | D. | CH4 |
15.下列四项都能导电,其中一项与其他三项导电原理不同的是( )
| A. | 氯化钠熔化导电 | B. | 液态汞导电 | ||
| C. | H2SO4溶液导电 | D. | 熔融状态的K0H导电 |
4.在80℃时,将0.8mol的A气体充入4L已抽空的固定容积的密闭容器中发生反应:A(g)?mB(g)隔一段时间对该容器内的物质进行分析,得到如下数据:
(1)m=2,表中b<c(填“<”、“=”或“>”).
(2)100秒后若将容器的体积缩小至原来一半,平衡时A的浓度>0.09mol/L(填“<”、“=”或“>”).
(3)在80℃时该反应的平衡常数K值为0.5(保留1位小数).
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时①②④.
①A的转化率越高 ②A与B的浓度之比越大 ③B的产量越大 ④正反应进行的程度越大.
| 时间(s) c(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(A) | 0.20 | 0.14 | b | 0.09 | 0.09 | 0.09 |
| c(B) | 0.00 | 0.12 | 0.20 | c | d | e |
(2)100秒后若将容器的体积缩小至原来一半,平衡时A的浓度>0.09mol/L(填“<”、“=”或“>”).
(3)在80℃时该反应的平衡常数K值为0.5(保留1位小数).
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时①②④.
①A的转化率越高 ②A与B的浓度之比越大 ③B的产量越大 ④正反应进行的程度越大.
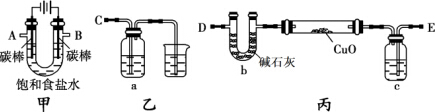 某化学研究性小组采用如下装置(夹持和加热仪器已略去)电解饱和食盐水一段时间,并通过实验测定产物的量来判断饱和食盐水的电解率.
某化学研究性小组采用如下装置(夹持和加热仪器已略去)电解饱和食盐水一段时间,并通过实验测定产物的量来判断饱和食盐水的电解率.