题目内容
20.根据如表提供的信息,下列判断错误的是( )| 第一周期 |  | ||
| 第二周期 |  | 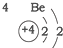 |  |
| 第三周期 | 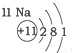 | 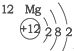 | 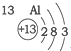 |
| A. | 元素所在的周期数等于其原子的电子层数 | |
| B. | 原子序数与元素原子核电荷数在数值上相同 | |
| C. | 第二、三周期元素的原子从左至右最外层电子数逐渐增多 | |
| D. | 金属元素的原子,其最外层电子数一般少于4个,在化学反应中易得到电子,趋向达到相对稳定结构 |
分析 A、依据元素周期数与原子结构的特点分析即可;
B、依据元素周期表是按照原子序数依次增多的顺序排列起来的,原子序数即原子核电荷数即可;
C、从二三周期的原子结构分析即可;
D、金属元素的原子,其最外层电子数一般少于4个,在化学反应中易失去电子.
解答 解:A、由图示及所学可知元素所在的周期数等于其原子的电子层数,故A正确;
B、元素周期表是按照原子序数依次增多的顺序排列起来的,原子序数即原子核电荷数,故B正确;
C、由图示可知第二、三周期元素的原子从左至右最外层电子数逐渐增多,故C正确;
D、金属元素的原子,其最外层电子数一般少于4个,在化学反应中易失去电子,故D错误.
故选:D.
点评 本题考查学生对元素周期律知识的理解与掌握,并能在解题中灵活应用的能力,属基础性知识考查题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.常温下,2L物质的量浓度为0.5mol•L-1Ba(OH)2溶液含有( )
| A. | 0.5mol的Ba2+ | B. | 0.5mol的H+ | C. | 1.0mol的H+ | D. | 2.0mol的OH- |
11.下列叙述正确的是( )
| A. | 中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需氢氧化钠多于醋酸 | |
| B. | 将氢氧化钠溶液和氨水各稀释一倍,两者的c(OH-)均减少到原来的一半 | |
| C. | 常温下,某溶液中由水电离出的c(OH-)=1×10-10 mol/L,该溶液可能是盐酸 | |
| D. | 如果盐酸的物质的量浓度是醋酸的两倍,则盐酸的c(H+)也是醋酸的两倍 |
15.海洋水族馆中,表演者需携带氧气瓶在水中与鱼“共舞”.氧气被压缩在钢瓶中,其原因正确的是( )
| A. | 氧分子的大小发生改变 | B. | 氧分子的质量发生改变 | ||
| C. | 氧分子变成了氧原子 | D. | 氧分子之间的间隔变小了 |
5.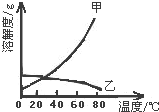 甲乙两种固体的溶解度曲线如图所示.有一个大烧杯中装着含有甲和乙的两种饱和溶液,而且杯中还有少量甲和乙的固体存在.现将温度由80℃降到20℃.下列说法错误的是( )
甲乙两种固体的溶解度曲线如图所示.有一个大烧杯中装着含有甲和乙的两种饱和溶液,而且杯中还有少量甲和乙的固体存在.现将温度由80℃降到20℃.下列说法错误的是( )
 甲乙两种固体的溶解度曲线如图所示.有一个大烧杯中装着含有甲和乙的两种饱和溶液,而且杯中还有少量甲和乙的固体存在.现将温度由80℃降到20℃.下列说法错误的是( )
甲乙两种固体的溶解度曲线如图所示.有一个大烧杯中装着含有甲和乙的两种饱和溶液,而且杯中还有少量甲和乙的固体存在.现将温度由80℃降到20℃.下列说法错误的是( )| A. | 杯中固体甲增多、固体乙减少 | |
| B. | 杯中一定有固体甲而不一定有固体乙 | |
| C. | 溶液中溶质甲减少、溶质乙增多 | |
| D. | 甲和乙的两种溶液仍然是饱和溶液 |
9.“酸化”是实验中经常采用的方法,下列说法正确的是( )
| A. | 提高高锰酸钾的氧化能力,用浓盐酸酸化 | |
| B. | 抑制Fe2+ 的水解,用稀硝酸酸化 | |
| C. | 检验某卤代烃中是否含氯元素,先加HNO3酸化,再加AgNO3溶液检验. | |
| D. | 确认溶液中含有SO42- 时,先用过量盐酸酸化,再加BaCl2溶液检验. |
10.下列分子式表示的物质一定是纯净物的是( )
| A. | C2H6O | B. | C2H4Cl2 | C. | CH4O | D. |  |