题目内容
12.根据如图所示装置回答下列问题.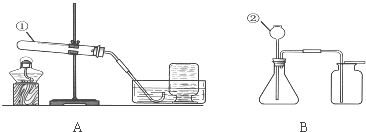
(1)仪器②的名称:②长颈漏斗.
(2)实验室可用装置A制取氧气.
①反应的化学方程式为2KClO3 $\frac{\underline{\;二氧化锰\;}}{△}$2KCl+3O2↑.
②装满氧气的集气瓶瓶口应向上(填“向上”或“向下”)放在桌面上.
(3)实验室可用装置B制取多种气体.
①若制取氧气,反应的化学方程式为2H2O2$\frac{\underline{\;二氧化锰\;}}{\;}$2H2O+O2↑,
②若制取二氧化碳,反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑.
分析 (1)熟悉常见仪器及用途,说出其名称;
(2)装置①为固体与液体加热反应制备气体;
②依据向上排空气法收集气体装置解答;
(3)依据发生装置为固体+液体不加热,收集装置为向上排空气法,则密度应大于空气密度,据此解答.
解答 解:(1)图中仪器②的名称长颈漏斗,用于向容器中加液体;
故答案为:长颈漏斗;
(2)①实验室用加热氯酸钾与二氧化锰的方法制备氧气,应选择①装置,反应的方程式为:2KClO3 $\frac{\underline{\;二氧化锰\;}}{△}$2KCl+3O2↑;
故答案为:2KClO3 $\frac{\underline{\;二氧化锰\;}}{△}$2KCl+3O2↑;
②向上排空气法收集气体,应使装满氧气的集气瓶瓶口向上放在桌面上;
故答案为:向上;
(3)①双氧水在二氧化锰催化剂条件下反应生成氧气,可以用②装置制备,方程式为:2H2O2$\frac{\underline{\;二氧化锰\;}}{\;}$2H2O+O2↑;
故答案为:2H2O2$\frac{\underline{\;二氧化锰\;}}{\;}$2H2O+O2↑;
②若制取二氧化碳,应用碳酸钙和稀盐酸反应,方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
故答案为:CaCO3+2HCl=CaCl2+H2O+CO2↑.
点评 本题为实验题,考查了常见气体制备的方法,明确反应物状态、反应条件是选择发生装置的关键,题目难度不大.

练习册系列答案
相关题目
2.下列关于有机物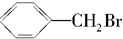 的说法不正确的是( )
的说法不正确的是( )
 的说法不正确的是( )
的说法不正确的是( )| A. | 所有的碳原子在同一个平面上 | |
| B. | 能够发生加成反应 | |
| C. | 不能发生消去反应 | |
| D. | 水解生成的有机物可与NaOH溶液反应 |
3.下列说法正确的是( )
| A. | 离子化合物中一定不含共价键,共价化合物中一定不含离子键 | |
| B. | 含有离子键的化合物一定是离子化合物 | |
| C. | 含有共价键的物质一定是共价化合物 | |
| D. | 分子间作用力越大,分子的热稳定性就越大 |
20.根据如表提供的信息,下列判断错误的是( )
| 第一周期 |  | ||
| 第二周期 |  | 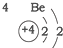 |  |
| 第三周期 | 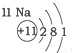 | 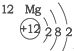 | 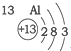 |
| A. | 元素所在的周期数等于其原子的电子层数 | |
| B. | 原子序数与元素原子核电荷数在数值上相同 | |
| C. | 第二、三周期元素的原子从左至右最外层电子数逐渐增多 | |
| D. | 金属元素的原子,其最外层电子数一般少于4个,在化学反应中易得到电子,趋向达到相对稳定结构 |
2.下列说法正确的是( )
| A. | 只有共价键形成的分子一定是共价化合物 | |
| B. | 含有金属阳离子的晶体一定是离子晶体 | |
| C. | 元素的非金属性越强,其单质的活泼性一定越强 | |
| D. | 分子晶体中一定存在分子间作用力,不一定存在共价键 |
 .
.