题目内容
5.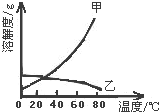 甲乙两种固体的溶解度曲线如图所示.有一个大烧杯中装着含有甲和乙的两种饱和溶液,而且杯中还有少量甲和乙的固体存在.现将温度由80℃降到20℃.下列说法错误的是( )
甲乙两种固体的溶解度曲线如图所示.有一个大烧杯中装着含有甲和乙的两种饱和溶液,而且杯中还有少量甲和乙的固体存在.现将温度由80℃降到20℃.下列说法错误的是( )| A. | 杯中固体甲增多、固体乙减少 | |
| B. | 杯中一定有固体甲而不一定有固体乙 | |
| C. | 溶液中溶质甲减少、溶质乙增多 | |
| D. | 甲和乙的两种溶液仍然是饱和溶液 |
分析 A、根据降温后溶解度变大还是变小考虑;
B、根据降温后变为饱和溶液还是不饱和溶液;
C、根据降温后溶液是否饱和来考虑;
D、根据降温后是析出溶质,还是又溶解了溶质考虑.
解答 解:A、由于甲的溶解度随温度的升高而增大,所以降温后会析出甲固体,杯中固体甲增多;由于乙的溶解度随温度的升高而减小,所以降温后变为不饱和溶液,会再溶解一部分固体乙,所以固体乙减少,故A正确;
B、由于甲的溶解度随温度的升高而增大,所以降温后会析出甲固体,杯中固体甲一定有,由于乙的溶解度随温度的升高而减小,所以降温后变为不饱和溶液,会再溶解固体乙,固体乙有可能全部溶解也有可能溶解一部分,所以不一定有固体乙,故B正确;
C、甲的溶解度随温度的升高而增大,所以降温后会析出甲固体,溶液中溶质甲减少;乙的溶解度随温度的升高而减小,所以降温后变为不饱和溶液,会再溶解固体乙,溶质乙增多;故C正确.
D、甲的溶解度随温度的升高而增大,所以降温后会析出甲固体,所以甲溶液一定饱和;乙的溶解度随温度的升高而减小,所以降温后变为不饱和溶液,会再溶解一部分固体乙,有可能固体乙全部溶解后还是不饱和,也有可能溶解固体乙后已经饱和,故D错误;
故选D.
点评 本题考查溶解度的相关知识,解答本题的关键是要知道饱和溶液不管是降温还是升温,只要溶解度增大,就会由饱和变为不饱和;只要溶解度减小就会析出晶体.

练习册系列答案
相关题目
16.咖啡酸具有止血功效,存在于多种中药中,其结构简式如图:则下列有关说法正确的是( )
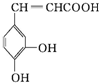

| A. | 该物质中苯环上一氯代物有2种 | |
| B. | 该分子结构中含有两种官能团 | |
| C. | 既能发生取代反应,也能发生加成反应 | |
| D. | 所有碳原子不可能都在同一个平面上 |
13.阿魏酸在食品、医药等方面有若干广泛用途.一种合成阿魏酸的反应可表示为
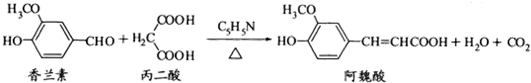
下列说法正确的是( )

下列说法正确的是( )
| A. | 可用酸性KMnO4溶液检测上述反应是否有阿魏酸生成 | |
| B. | 香兰素、阿魏酸均可与Na2CO3、NaOH、NaHCO3溶液反应 | |
| C. | 香兰素、阿魏酸都能发生取代、加成、消去反应 | |
| D. | 与香兰素互为同分异构体,分子中有4种不同化学环境的氢,且能发生银镜反应的酚类化合物共有2种 |
20.根据如表提供的信息,下列判断错误的是( )
| 第一周期 | 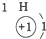 | ||
| 第二周期 | 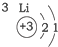 |  | 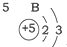 |
| 第三周期 | 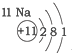 | 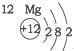 | 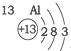 |
| A. | 元素所在的周期数等于其原子的电子层数 | |
| B. | 原子序数与元素原子核电荷数在数值上相同 | |
| C. | 第二、三周期元素的原子从左至右最外层电子数逐渐增多 | |
| D. | 金属元素的原子,其最外层电子数一般少于4个,在化学反应中易得到电子,趋向达到相对稳定结构 |
10.分类就是按照种类、等级或性质分别归类.依据不同的分类标准,结论也不尽相同.下列每组中有一种物质具有特殊的组成或性质,而其他两种物质的组成或性质相似.请你利用所学知识将其区分出来并说明理由.
| 化学式 | 被区分的物质(名称) | 理由 |
| Na2CO3、CaCO3、NaCl | NaCl | 由两种元素组成,或不含碳(或氧)元素 |
| C、CO2、H2CO3 | 碳 | 单质 |
15.某烃1mol最多能和2mol HCl加成,生成氯代烃,此氯代烃l mol能和6mol Cl2发生取代反应,生成物中只有碳氯两种元素,此烃为( )
| A. | C2H2 | B. | C2H4 | C. | C3H4 | D. | C4H6 |
