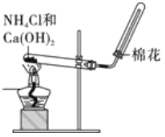
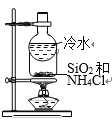
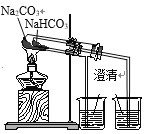
题目内容
【题目】在一定条件下,将充满NO2和O2的试管倒立于水槽中,充分反应后,剩余气体的体积为原混合气体体积的![]() ,则原混合气体中NO2和O2的体积之比是
,则原混合气体中NO2和O2的体积之比是
A.8:1B.7:3C.1:7D.4:1
【答案】B
【解析】
NO2和O2的混合气体通入倒立于水槽中盛满水的试管中,发生反应可能为:4NO2+O2+2H2O=4HNO3、3NO2+H2O=2HNO3+NO,剩余气体的体积为原混合气体的![]() ,试管中剩余
,试管中剩余![]() 体积的可能为NO或O2,结合反应方程式列式计算。
体积的可能为NO或O2,结合反应方程式列式计算。
发生反应为:4NO2+O2+2H2O=4HNO3、3NO2+H2O=2HNO3+NO,剩余气体的体积为原混合气体的![]() ,则试管中剩余
,则试管中剩余![]() 体积的为NO或O2。设NO2和O2的总体积为V,
体积的为NO或O2。设NO2和O2的总体积为V,
当剩余气体为NO时,说明氧气不足,生成![]() V体积的NO消耗二氧化氮的体积为:
V体积的NO消耗二氧化氮的体积为:![]() V×3=
V×3=![]() ;
;
则反应4NO2+O2+2H2O=4HNO3中总共消耗二氧化氮和氧气的总体积为:![]() ,原混合气体中氧气的体积为:
,原混合气体中氧气的体积为:![]() ×
×![]() =
=![]() V,原混合气体中二氧化氮的体积为:
V,原混合气体中二氧化氮的体积为:![]() ,原混合气体中NO2和O2的体积比为:
,原混合气体中NO2和O2的体积比为:![]() :
:![]() V=7:1;
V=7:1;
当氧气过量时,剩余的![]() V体积为O2,说明NO2不足量,则参加反应4NO2+O2+2H2O=4HNO3中总共消耗NO2和O2的总体积为
V体积为O2,说明NO2不足量,则参加反应4NO2+O2+2H2O=4HNO3中总共消耗NO2和O2的总体积为![]() ,混合气体中二氧化氮的总体积为:
,混合气体中二氧化氮的总体积为:![]() ×
×![]() =
=![]() ,O2总体积为
,O2总体积为![]() ,故原气体中NO2和O2的体积比为
,故原气体中NO2和O2的体积比为![]() :
:![]() =7:3,
=7:3,
故合理选项是B。

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】长期放置的FeSO4溶液易被氧化而变质,某兴趣小组进行了如下实验:
(1)设计实验检验FeSO4溶液的变质程度
实验方案 | 实验现象 | 实验结论 | |
步骤1 | 取待检测液于试管中,向其中滴加KSCN溶液 | ________ | FeSO4溶液部分变质 |
步骤2 | _____ | _________ | |
① 将上述方案补充完整
② 若要使部分变质的FeSO4复原,方法是__________。(写离子反应方程式)
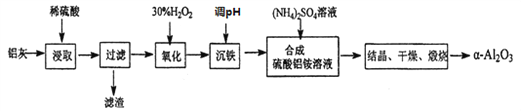
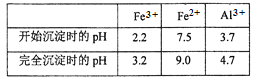
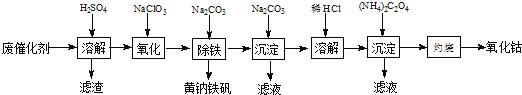
(2)利用部分变质的FeSO4溶液制备Fe2O3
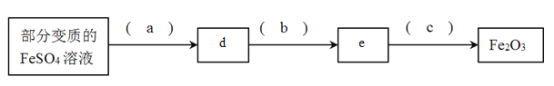
①填写下列各空:a._____b._______c.________d._____e.______
②若100mL该变质溶液制得1.6gFe2O3,则变质前FeSO4溶液的浓度为__________。
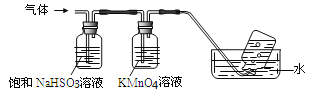
(3)FeSO4可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将Fe3+转化为Fe2+,以利于人体吸收。为了验证这一猜想,设计了如下实验:
实验方案 | 实验现象 |
取适量 Fe2(SO4)3溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液。 | 紫色褪去 |
由上述实验能否得出“维生素C可将Fe3+转化为Fe2+”的结论?请说明理由_______。