题目内容
【题目】以冶炼金属铝的废弃物铝灰为原料制取超细![]() -氧化铝,既能降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为A12O3(含少量杂质SiO2、FeO、Fe2O3),其制备流程如下:
-氧化铝,既能降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为A12O3(含少量杂质SiO2、FeO、Fe2O3),其制备流程如下:
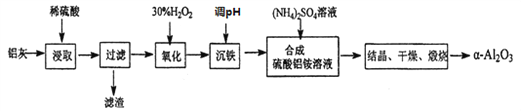
(1)用上图中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为____(填选项编号)。

(2)流程中加入H2O2 有气体产生,原因是_______________________________。
(3)通过调节溶液的pH来“沉铁”,得到Fe(OH)3。己知:
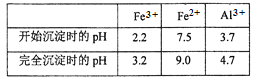
为保证产品的纯度,可以选用下列物质中的_______调节溶液pH(填字母),调节pH的范围为___________________________。
a.A12O3 b.NaOH c.Al(OH) 3 d.Na2CO3
(4)煅烧硫酸铝铵晶体,发生的主要反应为:
4[NH4 Al(SO4)2·12H2O] ![]() 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,
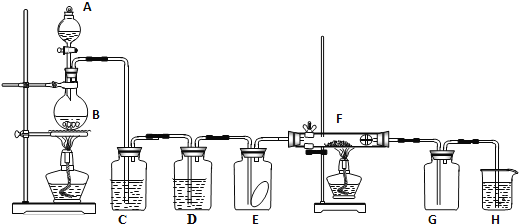
将产生的气体通过下图所示的装置:
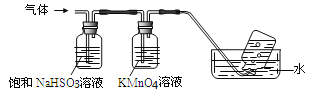
①集气瓶中收集到的气体是_____________________(填化学式);
②装有KMnO4溶液洗气瓶的作用是__________________________________;
③选用一种常用化学试剂和稀硝酸检验硫酸铝铵,该试剂是______________。
【答案】 B Fe3+对H2O2的分解有催化作用 a c 3.2≤pH<3.7 N2 吸收SO2 Ba(OH)2(溶液)
【解析】(1)能够焙烧固体的装置是坩埚,NaOH能和二氧化硅反应生成硅酸钠,所以不能采用瓷坩埚灼烧,所以应该采用铁坩埚,故选B
(2)在实验流程中,H2O2具有氧化性,能氧化亚铁离子生成铁离子,离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,而Fe3+对H2O2的分解有催化作用。
(3)为保证产品-氧化铝的纯度,可以选用a.A12O3 c.Al(OH) 3调节溶液pH。Fe3+开始沉淀的PH=2.2,沉淀完全的PH=3.2要使Fe3+完全沉淀调节pH的范围为3.2≤pH<3.7。答案:a c 3.2≤pH<3.7。
(4) ①因为4[NH4 Al(SO4)2·12H2O] ![]() 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,NH3 N2 SO3 SO2混合气体通入饱和亚硫酸钠溶液,NH3 SO3被吸收,剩余N2 SO2在通入酸性高锰酸钾溶液,SO2被吸收,剩余N2,所以集气瓶中收集到的气体是N2。
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,NH3 N2 SO3 SO2混合气体通入饱和亚硫酸钠溶液,NH3 SO3被吸收,剩余N2 SO2在通入酸性高锰酸钾溶液,SO2被吸收,剩余N2,所以集气瓶中收集到的气体是N2。
②装有KMnO4溶液洗气瓶的作用是吸收SO2气体。
③选用一种常用化学试剂和稀硝酸检验硫酸铝铵,鉴别硫酸根用Ba2= ,鉴别NH4+ 用OH-,所以该试剂是Ba(OH)2(溶液)。答案:Ba(OH)2(溶液)。

 直通贵州名校周测月考直通名校系列答案
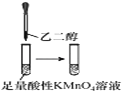
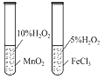
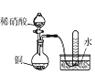
直通贵州名校周测月考直通名校系列答案【题目】下列实验能达到相应目的的是( )
选项 | A | B | C | D |
实验过程 |
|
|
|
|
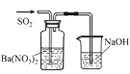
实验目的 | 将乙二醇转化为乙二酸 | 比较氯化铁和二氧化锰对H2O2分解反应的催化效果 | 证明稀硝酸与铜反应时表现出氧化性 | 用SO2与Ba(NO3)2反应获得BaSO3沉淀 |
A. A B. B C. C D. D