题目内容
【题目】长期放置的FeSO4溶液易被氧化而变质,某兴趣小组进行了如下实验:
(1)设计实验检验FeSO4溶液的变质程度
实验方案 | 实验现象 | 实验结论 | |
步骤1 | 取待检测液于试管中,向其中滴加KSCN溶液 | ________ | FeSO4溶液部分变质 |
步骤2 | _____ | _________ | |
① 将上述方案补充完整
② 若要使部分变质的FeSO4复原,方法是__________。(写离子反应方程式)
(2)利用部分变质的FeSO4溶液制备Fe2O3
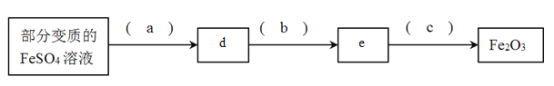
①填写下列各空:a._____b._______c.________d._____e.______
②若100mL该变质溶液制得1.6gFe2O3,则变质前FeSO4溶液的浓度为__________。
(3)FeSO4可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将Fe3+转化为Fe2+,以利于人体吸收。为了验证这一猜想,设计了如下实验:
实验方案 | 实验现象 |
取适量 Fe2(SO4)3溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液。 | 紫色褪去 |
由上述实验能否得出“维生素C可将Fe3+转化为Fe2+”的结论?请说明理由_______。
【答案】溶液变红 取待检测液于试管中,向其中滴加少量酸性高锰酸钾溶液 紫色褪去 2Fe3++ Fe = 3Fe2+ H2O2 NaOH Fe3+ Fe(OH)3 0.2mol/L 不能,维生素C可能过量,也可使高锰酸钾溶液褪色,则无法说明一定有Fe2+生成
【解析】
(1)①要想证明FeSO4溶液部分变质,需要证明溶液中含有Fe3+和Fe2+;
②若要使变质的FeSO4溶液复原,可以向溶液中加入过量的Fe粉,再经过滤除去剩余的Fe粉即可;
(2)①利用部分变质的FeSO4溶液制备Fe2O3的路线为:![]() ;
;
②根据Fe元素守恒进行计算;
(3)Fe2+和维生素C都具有还原性,若维生素C过量,也可使高锰酸钾溶液褪色,则无法说明一定有Fe2+生成。
(1)①要想证明FeSO4溶液部分变质,需要证明溶液中含有Fe3+和Fe2+;步骤1中,向待测液中加入KSCN溶液,溶液变为血红色,说明溶液中含有Fe3+;步骤2中,向待测液中加入酸性KMnO4溶液,酸性KMnO4溶液褪色,说明溶液中含有Fe2+;
②若要使变质的FeSO4溶液复原,可以向溶液中加入过量的Fe粉,再经过滤除去剩余的Fe粉即可,反应的离子方程式为2Fe3++Fe=3Fe2+;
(2)①利用部分变质的FeSO4溶液制备Fe2O3的路线为:![]() ,故a为H2O2,b为Fe2(SO4)3、c为NaOH、d为Fe(OH)3,e为△;
,故a为H2O2,b为Fe2(SO4)3、c为NaOH、d为Fe(OH)3,e为△;
②n(Fe2O3)=![]() =0.01mol,则变质前,100mL FeSO4溶液中,n(FeSO4)=0.02mol,故c(FeSO4)=
=0.01mol,则变质前,100mL FeSO4溶液中,n(FeSO4)=0.02mol,故c(FeSO4)=![]() =0.2mol/L;
=0.2mol/L;
(3)该实验现象不能验证猜想,因为维生素C也具有还原性,若维生素C过量,也可使高锰酸钾溶液褪色,则无法说明一定有Fe2+生成。

【题目】以![]() 、软锰矿(主要成分为
、软锰矿(主要成分为![]() ,少量
,少量![]() 及
及![]() 的化合物等)、氨水及净化剂等为原料可制备
的化合物等)、氨水及净化剂等为原料可制备![]() 液和
液和![]() ,主要实验步骤如下
,主要实验步骤如下

步骤I、如图所示装置,将![]() 通入
通入![]() 中的软锰矿浆液中
中的软锰矿浆液中![]() 。
。
步骤II、充分反应后,在不断搅拌下依次向仪器![]() 中加入适量纯净的
中加入适量纯净的![]() ,最后加入适量
,最后加入适量![]() 沉铅,
沉铅,
步骤III、过滤得![]() 溶液
溶液
(1)仪器R的名称是_______。
(2)装置![]() 用于制取
用于制取![]() ,反应的化学方程式为_________。
,反应的化学方程式为_________。
(3)装置![]() 中的反应应控制在90~100℃,适宜的加热方式是______________。
中的反应应控制在90~100℃,适宜的加热方式是______________。
(4)装置![]() 的作用是______________________。
的作用是______________________。
(5)“步骤Ⅱ”中加入纯净![]() 的目的是_______________,用
的目的是_______________,用![]() 调节溶液
调节溶液![]() 时,需调节溶液
时,需调节溶液![]() 的范围为________(该实验条件下,部分金属离子开始沉淀和沉淀完全的
的范围为________(该实验条件下,部分金属离子开始沉淀和沉淀完全的![]() 如下表)
如下表)
金属离子 |
|
|
|
|
开始沉淀的 | 7.04 | 1.87 | 3.32 | 7.56 |
沉淀完全的 | 9.18 | 3.27 | 4.9 | 10.2 |
(6)已知①用空气氧化![]() 浊液可制备
浊液可制备![]() ,主要副产物为
,主要副产物为![]() ;反应温度和溶液
;反应温度和溶液![]() 对产品中
对产品中![]() 的质量分数的影响分别如图所示
的质量分数的影响分别如图所示

②反应温度超过![]() 时,
时,![]() 的产率开始降低,
的产率开始降低,![]() 是白色沉淀,
是白色沉淀,![]() 呈黑色;
呈黑色;![]() 、
、![]() 中锰的质量分数理论值依次为72.05%、62.5%请补充完整由步骤III得到
中锰的质量分数理论值依次为72.05%、62.5%请补充完整由步骤III得到![]() 溶液,并用氨水等制备较纯净的
溶液,并用氨水等制备较纯净的![]() 的实验方案:______________________,真空干燥6小时得产品
的实验方案:______________________,真空干燥6小时得产品![]() 。
。