题目内容
【题目】红钠矾(重铬酸钠: Na2Cr2O72H2O )是重要的基础化工原料,易溶于水,有强氧化性 ,极毒。2012 年中国科学院研究所发明了以铬酸钡为中间体,由铭酸钾制备高纯度重铬酸钠的方法。该方法的转化条件温和,污染物排放少,流程如下所示。
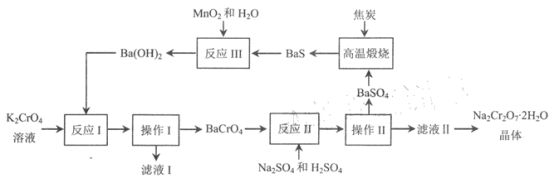
回答下列问题:
(1)操作I和操作II的名称均是 ____________, 滤液 I中溶质的主要成分的化学式为_____________。
(2)反应I、II、III中属于氧化还原反应的是____________________。
(3)高温煅烧时需加入过量焦炭,发生反应的化学方程式为 ________________.
(4)从平衡角度分析,反应 II 加H2SO4调节 pH 的原因是_______________(用离子方程式表示); 反应 II 不能用 HCl 替代H2SO4 的原因是_________________。
(5)含Cr2O72- 的废水需经化学处理,使其浓度降至符合国家有关标准方可排放。通常可在酸性废水中先加入适量绿矾(FeSO47H2O ) ,将Cr2O72- 还原成Cr3+,发生反应的离子方程式为___________, 再加入过量的石灰水,使 Cr3+转变为Cr(OH)3沉淀。用该方法处理 c(Cr2O72-) =1.5×10-3 mol·L-1的废水 10 m3,至少需要绿矾______kg。
【答案】过滤 KOH III BaSO4+4C ![]() BaS+4CO↑ 2CrO42-+2H+
BaS+4CO↑ 2CrO42-+2H+![]() Cr2O72-+H2O HCl易将Cr2O72- 还原为 Cr3+ (合理即可) 6Fe2++ Cr2O72-+ 14H+=6Fe 3++2 Cr3++7H2O 25.02
Cr2O72-+H2O HCl易将Cr2O72- 还原为 Cr3+ (合理即可) 6Fe2++ Cr2O72-+ 14H+=6Fe 3++2 Cr3++7H2O 25.02
【解析】
根据流程图分析知,K2CrO4溶液中加入Ba(OH)2反应I为:K2CrO4+ Ba(OH)2= BaCrO4↓+KOH,操作I为过滤,滤液I中主要化学成分为KOH;滤渣BaCrO4与硫酸钠发生反应II:BaCrO4+Na2SO4= BaSO4↓+ Na2CrO4,加入硫酸溶液调节pH,目的是使反应生成的铬酸根转化为重铬酸根,离子方程式为2CrO42-+2H+![]() Cr2O72-+H2O;操作II为过滤,分离出滤渣BaSO4,滤液II的主要成分为Na2Cr2O7,结晶后得到高纯度Na2Cr2O72H2O晶体;硫酸钡沉淀与焦炭高温煅烧得到BaS,反应为BaSO4+4C
Cr2O72-+H2O;操作II为过滤,分离出滤渣BaSO4,滤液II的主要成分为Na2Cr2O7,结晶后得到高纯度Na2Cr2O72H2O晶体;硫酸钡沉淀与焦炭高温煅烧得到BaS,反应为BaSO4+4C ![]() BaS+4CO↑;BaS经反应III制备Ba(OH)2,反应为:BaS+MnO2+H2O=MnO+S+Ba(OH)2,MnO被氧化后生成MnO2可循环利用。
BaS+4CO↑;BaS经反应III制备Ba(OH)2,反应为:BaS+MnO2+H2O=MnO+S+Ba(OH)2,MnO被氧化后生成MnO2可循环利用。
(1)根据上述分析,反应I和反应II分别生成BaCrO4沉淀和BaSO4沉淀,所以操作I和操作II目的是分离出沉淀,操作名称为过滤;滤液I中溶质的主要成分的化学式为KOH,故答案为:过滤;KOH;
(2)反应I、II为复分解反应,反应III中S2-被MnO2氧化,所以属于氧化还原反应的是反应III,故答案为:III;
(3)高温煅烧时需加入过量焦炭,BaSO4被焦炭还原生成BaS,C被氧化生成CO,反应的化学方程式为 BaSO4+4C ![]() BaS+4CO↑,故答案为:BaSO4+4C
BaS+4CO↑,故答案为:BaSO4+4C ![]() BaS+4CO↑;
BaS+4CO↑;
(4)反应II中加H2SO4调节pH,目的是使反应生成的铬酸根转化为重铬酸根,离子方程式为2CrO42-+2H+![]() Cr2O72-+H2O;反应II不能用 HCl 替代H2SO4 的原因是HCl易将Cr2O72- 还原为 Cr3+,故答案为:2CrO42-+2H+
Cr2O72-+H2O;反应II不能用 HCl 替代H2SO4 的原因是HCl易将Cr2O72- 还原为 Cr3+,故答案为:2CrO42-+2H+![]() Cr2O72-+H2O;HCl易将Cr2O72- 还原为 Cr3+;
Cr2O72-+H2O;HCl易将Cr2O72- 还原为 Cr3+;
(5) Fe2+将Cr2O72-还原成Cr3+,本身被氧化为Fe3+,根据电子转移守恒及电荷守恒进行缺项配平得到反应的离子方程式为6Fe2++ Cr2O72-+ 14H+=6Fe 3++2 Cr3++7H2O;根据上述反应得到关系:6Fe2+~Cr2O72-,则n(FeSO47H2O)=6n(Cr2O72-)=6×1.5×10-3/span>mol·L-1×10×103L=90mol,则m(FeSO47H2O)=278g/mol×90mol=25.02 kg,故答案为:6Fe2++ Cr2O72-+ 14H+=6Fe 3++2 Cr3++7H2O;25.02。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案