题目内容
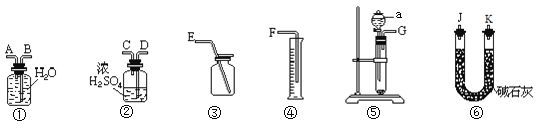
【题目】下列图示方法不能完成相应实验的是
A. 实验室制取并收集NH3
实验室制取并收集NH3
B.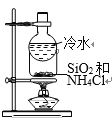 分离SiO2和NH4Cl
分离SiO2和NH4Cl
C.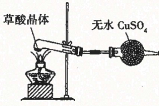 检验草酸晶体中是否含有结晶水
检验草酸晶体中是否含有结晶水
D. 验证热稳定性:Na2CO3>NaHCO3
验证热稳定性:Na2CO3>NaHCO3
【答案】C
【解析】
A.氯化铵和氢氧化钙加热可以制氨气,氨气密度比空气小,用向下排空气法收集,试管口放一团棉花防止氨气逸散到空气中,故A可以实现;
B.SiO2受热不反应,NH4Cl受热分解生成HCl和NH3气体,HCl和NH3气体遇冷重新生成NH4Cl,附在圆底烧瓶下方,从而实现SiO2和NH4Cl的分离,故B可以实现;
C.无水硫酸铜遇水变蓝,且草酸中含有氢元素,变蓝不能说明草酸中含结晶水,故C不能实现;
D.碳酸钠受热不易分解,碳酸氢钠受热易分解生成碳酸钠、水和二氧化碳,所以要验证热稳定性,碳酸钠应该在大试管中、碳酸氢钠在小试管中,故D可以实现;
故答案选C。

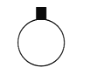
【题目】“硫代硫酸银”( [ Ag(S2O3)2]3–)常用于切花保鲜,由AgNO3溶液(0.1 mol·L–1 、pH=6)和Na2S2O3溶液(0.1 mol·L–1、pH=7)现用现配制。某小组探究其配制方法。
(实验一)
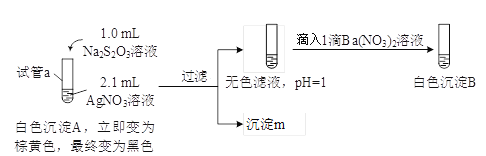
(1)A为Ag2S2O3。写出生成A的离子方程式__________。
(2)对实验现象的分析得出,试管a中充分反应后一定生成了__________(填离子符号)。进而推测出沉淀m可能为Ag2S、Ag、S或它们的混合物。做出推测的理由是__________。
(3)若试管a中物质充分反应后不过滤,继续加入1.1 mL Na2S2O3溶液,振荡,静置,黑色沉淀不溶解,清液中逐渐出现乳白色浑浊,有刺激性气味产生。用离子方程式解释产生白色浑浊的原因:__________。
结论:Ag2S2O3不稳定,分解所得固体不溶于Na2S2O3溶液。
(实验二)已知:Ag2S2O3 +3S2O32- ![]() 2 [ Ag(S2O3)2]3–(无色)
2 [ Ag(S2O3)2]3–(无色)
实验操作 | 实验现象 |
i. | 白色沉淀生成,振荡后迅速溶解,得到无色清液; 滴加至约1 mL时清液开始略显棕黄色,有丁达尔现象; 超过1.5 mL后,产生少量白色沉淀,立即变为棕黄色,最终变为黑色; 滴加完毕,静置,得到黑色沉淀,上层清液pH = 5 |
ii. | 白色沉淀生成,立即变为棕黄色,充分振荡后得到棕黄色清液,有丁达尔现象。 |
(4)用平衡移动原理解释实验i中加入1.5 mL AgNO3后产生白色沉淀的原因:__________。
(5)实验i中,当加入0.5 mL AgNO3溶液时,得到无色清液,若放置一段时间,无明显变化。结合化学反应速率分析该现象与ii不同的原因是__________。
(6)简述用0.1 mol·L–1 AgNO3溶液和0.1 mol·L–1 Na2S2O3溶液配制该保鲜剂时,试剂的投料比和操作:__________。