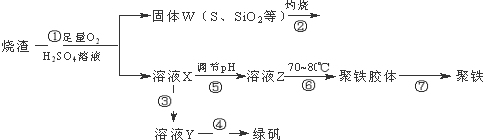
题目内容
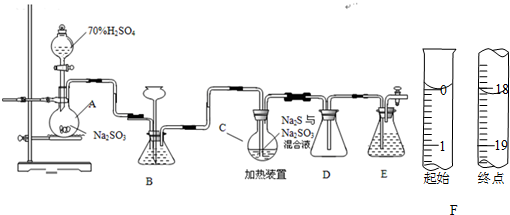
9.氯化硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,熔点为-80℃,沸点137.1℃.在空气中强烈发烟,易与水发生水解反应.人们使用它作橡胶硫化剂,使橡胶硫化,改变生橡胶热发粘冷变硬的不良性能.在熔融的硫中通入氯气即可生成S2Cl2.下图是实验室用S和Cl2制备S2Cl2的装置(夹持装置、加热装置均已略去).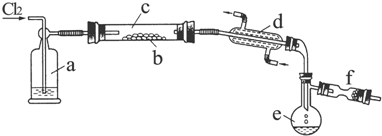
(1)仪器名称:d直形冷凝管(或冷凝管);e蒸馏烧瓶
(2)已知S2Cl2分子中各原子最外层均满足8电子稳定结构,则S2Cl2的电式
 .
.(3)装置a中应放试剂为浓H2SO4,f装置中试剂的作用吸收尾气中的Cl2,防止空气中的水汽使S2Cl2水解
(4)该实验的操作顺序应为②③①⑤④(或③②①⑤④) (用序号表示).
①加热装置C ②通入Cl2 ③通入冷水 ④停止通Cl2 ⑤停止加热装置C
(5)已知S2Cl2水解时,只有一种元素的化合价发生了变化,且被氧化和被还原的该元素的物质的量之比为1:3,请写出该反应的化学方程式2S2Cl2+2H2O=SO2+3S+4HCl.
分析 本题是利用在熔融的硫中通入氯气即可生成S2Cl2的原理制备S2Cl2,因氯化硫是一种黄红色液体,有刺激性、窒息性恶臭,熔点为-80℃,沸点137.1℃.在空气中强烈发烟,易与水发生水解反应,结合这些性质特征,通入的氯气需要干燥、含有氯气的尾气需要吸收,整套反应装置和收集装置需要保持干燥,据此可作答.
(1)根据仪器的形状及常见仪器来确定名称;
(2)S2Cl2分子结构与H2O2相似,S2Cl2分子中氯原子与硫原子之间形成1对共用电子对,硫原子与硫原子之间形成1对共用电子对;
(3)由信息可知S2Cl2遇水水解,进入b中的气体应该干燥,F装置盛放碱石灰,吸收Cl2尾气,防止空气中的水汽加入e中;
(4)加热之前先通冷凝水,否则开始生成的S2Cl2不能冷却液化,最后先停止加热后停止通氯气,平衡容器内压强,防止发生危险;
(5)只有硫元素化合价发生变化
解答 解:(1)d为冷凝管,e为蒸馏烧瓶,故答案为:直形冷凝管(或冷凝管);蒸馏烧瓶;
(2)S2Cl2分子结构与H2O2相似,S2Cl2分子中氯原子与硫原子之间形成1对共用电子对,硫原子与硫原子之间形成1对共用电子对,S2Cl2电子式为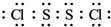 ,故答案为:
,故答案为: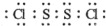 ;
;
(3)由信息可知S2Cl2遇水水解,进入b中的气体应该干燥,可选择用浓硫酸干燥,F装置盛放碱石灰,吸收Cl2尾气,防止污染环境,防止空气中的水汽加入e中使S2Cl2水解,故答案为:浓H2SO4;碱石灰;吸收尾气中的Cl2,防止空气中的水汽使S2Cl2水解;
(4)加热之前先通冷凝水,否则开始生成的S2Cl2不能冷却液化,最后先停止加热后停止通氯气,平衡容器内压强,防止发生危险.所以实验操作顺序为②③①⑤④(或③②①⑤④)故答案为:②③①⑤④(或③②①⑤④).
(5)只有硫元素化合价发生变化,且被氧化和被还原的物质的量之比为1:3,化学方程式:2S2Cl2+2H2O=SO2↑+3S↓+4HCl,故答案为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl.
点评 本题考查学生对实验原理及装置的理解、评价,阅读题目获取信息的能力等,关键是掌握整个制备流程原理,分析流程中各装置的作用,要求学生要有扎实的实验基础知识和灵活应用信息解决问题的能力,难度中等.

| 选项 | X | Y | Z | M |
| A | Fe(s) | FeCl2 | FeCl3 | Cl2 |
| B | NaOH(aq) | Na2CO3 | NaHCO3 | CO2 |
| C | NH3(g) | NO | NO2 | O2 |
| D | S(s) | SO2 | SO3 | O2 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
| A. | 19%的MgCl2 溶液中,Cl-与H2O个数比为4:45 | |
| B. | 为检验酸性溶液中Cl-和 SO42-,先加硝酸银溶液,滤去沉淀后滤液中加硝酸钡溶液 | |
| C. | S8和NO2都是共价化合物,NH4Cl 和CaC2都是离子化合物 | |
| D. | 若ⅡA某元素的原子序数为m,则同周期ⅢA元素的原子序数可能为m+10 |
| 活性炭 | NO | E | F | |
| 初始时(mol) | 2.050 | 0.200 | 0 | 0 |
| 平衡时(mol) | 2.000 | 0.100 | 0.050 | 0.050 |
| A. | 该反应的平衡常数为$\frac{1}{4}$ | |
| B. | 增加活性炭的量,能缩短达到平衡所用的时间 | |
| C. | 容器中压强不变可以说明该反应达到平衡状态 | |
| D. | 达到平衡时,用E表示该反应的速率为0.01 mol•L-1•min-1 |
 某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则
某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则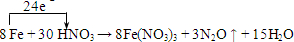 .
.