题目内容
18.硼氢化钠(NaBH4)在化工等领域具有重要的应用价值,某研究小组采用偏硼酸钠NaBO2为主要原料制备NaBH4,其流程如图: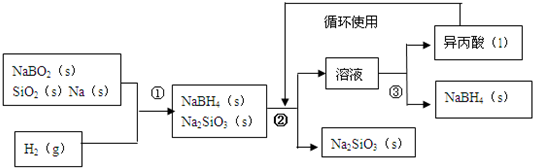
已知:NaBH4常温下能与水反应,可溶于异丙酸(沸点:13℃).
(1)在第①步反应加料之前,需要将反应器加热至100℃以上并通入氩气,该操作的目的是:除去反应器中的水蒸气和空气.
(2)请配平第①步反应的化学方程式:
1NaBO2+2SiO2+4Na+2H2----1NaBH4+2Na2SiO3
(3)第②步操作需要的玻璃仪器有:烧杯、漏斗、玻璃棒;第③步分离出NaBH4并回收溶剂,采用的操作方法是蒸馏.
(4)NaBH4与水反应生成NaBO2,且反应前后B的化合价不变,该反应的化学方程式为:NaBH4+2H2O=NaBO2+4H2↑,反应消耗1molNaBH4时转移的电子数目为4NA.
分析 NaBO2、SiO2、Na和H2在一定条件下反应生成NaBH4、Na2SiO3,NaBH4常温下能与水反应,且氢气和氧气混合加热易产生爆炸现象,为防止NaBH4水解、防止产生安全事故,需要将装置中的空气和水蒸气排出;NaBH4可溶于异丙酸,根据③知,②中加入的溶剂是异丙酸,NaBH4溶解于异丙酸、Na2SiO3不溶于异丙酸,难溶性固体和溶液采用过滤方法分离,通过过量得到滤液和滤渣,滤渣成分是Na2SiO3;异丙酸沸点:33℃,将滤液采用蒸馏的方法分离,得到异丙酸和固体NaBH4,
(1)为防止安全事故发生和防止NaBH4水解,在第①步反应加料之前,需要将反应器加热至100℃以上并通入氩气,从而排出空气和水蒸气;
(2)该反应中H元素化合价由0价变为-1价、Na元素化合价由0价变为+1价,根据转移电子守恒、原子守恒配平方程式;
(3)分离难溶性固体和溶液采用过滤方法,然后确定仪器;熔沸点相差较大的可以采用蒸馏方法;
(4)NaBH4与水反应生成NaBO2,且反应前后B的化合价不变,H元素化合价由-1价、+1价变为0价,再结合转移电子守恒配平方程式,根据NaBH4和转移电子之间的关系式计算.
解答 解:(1)NaBH4常温下能与水反应,且氢气和氧气混合加热易产生爆炸现象,为防止NaBH4水解、防止产生安全事故,需要将装置中的空气和水蒸气排出;
故答案为:除去反应器中的水蒸气和空气;
(2)该反应中H元素化合价由0价变为-1价、Na元素化合价由0价变为+1价,转移电子总数为4,根据转移电子守恒、原子守恒配平方程式为:NaBO2+2SiO2+4Na+2H2═NaBH4+2Na2SiO3,
故答案为:1;2;4;2;1;2;
(3)②中加入的溶剂是异丙酸,NaBH4溶解与异丙酸、Na2SiO3不溶于异丙酸,所以第②步分离采用的方法是过滤,需要的仪器有:烧杯、漏斗、玻璃棒;熔沸点相差较大的可以采用蒸馏方法,异丙酸沸点:33℃,将滤液采用蒸馏的方法分离,得到异丙酸和固体NaBH4;
故答案为:烧杯、漏斗、玻璃棒;蒸馏;
(4)NaBH4与水反应生成NaBO2,且反应前后B的化合价不变,NaBO2中B元素化合价为+3价,所以NaBH4中H元素的化合价为-1价,所以H元素化合价由-1价、+1价变为0价,再结合转移电子守恒配平方程式为NaBH4+2H2O=NaBO2+4H2↑,反应消耗1mol NaBH4时转移的物质的量=1mol×4×(1-0)=4mol,所以转移电子数为4NA或2.408×1024;
故答案为:NaBH4+2H2O=NaBO2+4H2↑;4NA.
点评 本题考查物质制备实验方案设计,侧重考查学生分析推断及知识综合应用能力,涉及物质分离提纯、氧化还原反应、实验基本操作等知识点,综合性较强且较基础,难点是分析流程图中发生的反应、基本操作等,题目难度中等.

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案| 选项 | X | Y | Z | M |
| A | Fe(s) | FeCl2 | FeCl3 | Cl2 |
| B | NaOH(aq) | Na2CO3 | NaHCO3 | CO2 |
| C | NH3(g) | NO | NO2 | O2 |
| D | S(s) | SO2 | SO3 | O2 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
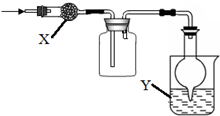 如图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是( )
如图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是( ) | 选项 | X | 收集气体 | Y |
| A | 碱石灰 | 氯气 | 氢氧化钠 |
| B | 碱石灰 | 氯化氢 | 氢氧化钠 |
| C | 氯化钙 | 二氧化硫 | 氢氧化钠 |
| D | 氯化钙 | 一氧化氮 | 氢氧化钠 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 反应过程只有O2生成,共6.72 L的气体(标况) | |
| B. | 本过程一共涉及了三个化学反应 | |
| C. | 最终得到氢氧化铝的沉淀 | |
| D. | 最终得到的溶液中c(NaCl)=0.15 mol•L-1 |
| A. | 2gH2含有的氢原子数目为NA | |
| B. | 常温下,1molCl2与足量NaOH溶液完全反应,转移的电子数为2NA | |
| C. | 常温常压下,11.2L氧气含有的原子数目为NA | |
| D. | 1L1 mol•L-1 KOH溶液中含有的钾离子数目为NA |
| A. | 19%的MgCl2 溶液中,Cl-与H2O个数比为4:45 | |
| B. | 为检验酸性溶液中Cl-和 SO42-,先加硝酸银溶液,滤去沉淀后滤液中加硝酸钡溶液 | |
| C. | S8和NO2都是共价化合物,NH4Cl 和CaC2都是离子化合物 | |
| D. | 若ⅡA某元素的原子序数为m,则同周期ⅢA元素的原子序数可能为m+10 |
| 活性炭 | NO | E | F | |
| 初始时(mol) | 2.050 | 0.200 | 0 | 0 |
| 平衡时(mol) | 2.000 | 0.100 | 0.050 | 0.050 |
| A. | 该反应的平衡常数为$\frac{1}{4}$ | |
| B. | 增加活性炭的量,能缩短达到平衡所用的时间 | |
| C. | 容器中压强不变可以说明该反应达到平衡状态 | |
| D. | 达到平衡时,用E表示该反应的速率为0.01 mol•L-1•min-1 |
 名称为3-甲基-2-丙基-1-戊烯.
名称为3-甲基-2-丙基-1-戊烯. 名称为1-甲基-3-乙基苯.
名称为1-甲基-3-乙基苯. 名称为:2,4-二甲基-3-乙基戊烷.
名称为:2,4-二甲基-3-乙基戊烷.