题目内容
11.已知:①稀硝酸有强氧化剂,其还原产物通常为NO气体;②铁可被稀硝酸氧化生成Fe2+或Fe3+.
现将16.8g铁粉投入到含b molHNO3的稀硝酸中,
(1)写出可能发生的两个反应的化学方程式.
(2)当0.8<b<1.2时,试分析反应后溶液中溶质的成分及物质的量.
分析 (1)当铁足量时,铁与稀硝酸反应生成硝酸亚铁,当铁不足时,二者反应生成硝酸铁,据此写出反应的化学方程式;
(2)先根据n=$\frac{m}{M}$计算出16.8g铁的物质的量,再根据反应方程式讨论反应产物完全为硝酸铁或硝酸亚铁时需要消耗硝酸的物质的量,再根据题中b的范围确定产物组成,最后列出方程组计算即可.
解答 解:(1)铁与稀硝酸的反应中,当当铁足量时,铁与稀硝酸反应生成硝酸亚铁、NO气体和水,反应的化学方程式为:3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O;当铁不足时,二者反应生成硝酸铁、NO气体和水,反应的化学方程式为:Fe+4HNO3═Fe(NO3)3+NO↑+2H2O,
答:可能发生的两个反应的化学方程式为:3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O或Fe+4HNO3═Fe(NO3)3+NO↑+2H2O;
(2)16.8g铁的物质的量为:$\frac{16.8g}{56g/mol}$=0.3mol,根据反应方程式3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O、Fe+4HNO3═Fe(NO3)3+NO↑+2H2O可知,当生成的完全为硝酸铁时,消耗硝酸的物质的量为:0.3mol×$\frac{4}{1}$=1.2mol,当生成的完全为硝酸亚铁时,消耗硝酸的物质的量为:0.3mol×$\frac{8}{3}$=0.8mol,
由于硝酸的物质的量b满足0.8<b<1.2,所以反应生成的产物是Fe(NO3)2和Fe(NO3)3的混合物,
设反应生成Fe(NO3)2和Fe(NO3)3的物质的量分别为x、y,
则:$\left\{\begin{array}{l}{x+y=0.3}\\{\frac{8}{3}x+4y=b}\end{array}\right.$,
解得:x=$\frac{3.6-3b}{4}$mol、y=$\frac{3b-2.4}{4}$mol,
答:当0.8<b<1.2时,反应后溶液中溶质为Fe(NO3)2和Fe(NO3)3,物质的量分别为Fe(NO3)2:$\frac{3.6-3b}{4}$mol、Fe(NO3)3:$\frac{3b-2.4}{4}$mol.
点评 本题考查了有关范围讨论的计算、混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握讨论法、质量守恒定律在化学计算中应用方法,试题培养了学生的分析能力及化学计算能力.

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案| 活性炭 | NO | E | F | |
| 初始时(mol) | 2.050 | 0.200 | 0 | 0 |
| 平衡时(mol) | 2.000 | 0.100 | 0.050 | 0.050 |
| A. | 该反应的平衡常数为$\frac{1}{4}$ | |
| B. | 增加活性炭的量,能缩短达到平衡所用的时间 | |
| C. | 容器中压强不变可以说明该反应达到平衡状态 | |
| D. | 达到平衡时,用E表示该反应的速率为0.01 mol•L-1•min-1 |
| A. | 通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动 | |
| B. | 光线透过胶体时,胶体发生了丁达尔现象 | |
| C. | 用渗析的方法净化胶体时,半透膜只允许较小的分子、离子通过 | |
| D. | 胶体粒子具有较大的表面积,能吸附阳离子或阴离子,故在电场的作用下会产生电泳现象 |
| A. | 邻二甲苯苯环上的一氯取代产物有4种 | |
| B. | 甲苯分子中最多有12个原子在同一平面内 | |
| C. | 乙二醇与甘油互为同系物 | |
| D. | 油脂在烧碱溶液中能发生水解反应 |
| A. | 1 | B. | 100 | C. | 1000 | D. | 10000 |
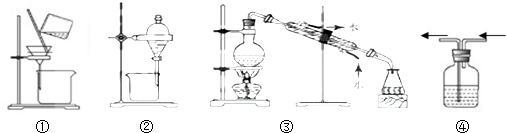 ( )
( )| A. | 提纯含NaCl的氢氧化铁胶体用装置① | |
| B. | 分离碘的四氯化碳溶液用② | |
| C. | 分离NaCl的酒精溶液用装置③ | |
| D. | 除去Cl2中的HCl气体用装置④ |
| A. | 分子大小不同 | B. | 分子间的平均距离不同 | ||
| C. | 分子性质不同 | D. | 分子数目不同 |

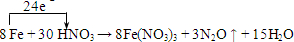 .
.