题目内容
10.把石灰石浸入盐酸中,下列措施能使反应速率增大的是( )①加大盐酸用量 ②增大盐酸浓度 ③粉碎石灰石 ④增大体系压强.
| A. | ①③ | B. | ②③ | C. | ①④ | D. | ③④ |
分析 根据影响反应速率的盐酸,升高温度、增大固体的接触面积、增大反应物浓度都可以加快反应速率,以此解答.
解答 解:①盐酸的浓度影响反应速率,与物质的量无关,故错误;
②增大反应物浓度,可以加快反应速率,故正确;
③粉碎石灰石,可以增大接触面积,增大了反应速率,故正确;
④反应在溶液中进行,增大压强对反应速率基本没有影响,故错误.
故选B.
点评 本题考查化学反应速率的影响因素,侧重于基本概念的理解和应用,为高考常见题型和高频考点,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
7.下列有关叙述中正确的是( )
| A. | 19%的MgCl2 溶液中,Cl-与H2O个数比为4:45 | |
| B. | 为检验酸性溶液中Cl-和 SO42-,先加硝酸银溶液,滤去沉淀后滤液中加硝酸钡溶液 | |
| C. | S8和NO2都是共价化合物,NH4Cl 和CaC2都是离子化合物 | |
| D. | 若ⅡA某元素的原子序数为m,则同周期ⅢA元素的原子序数可能为m+10 |
1.活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),反应方程式为NO+C?E+F(未配平).当温度为T时,经过5min达到平衡,测得平衡时各物质的物质的量如下表:
则下列说法正确的是( )
| 活性炭 | NO | E | F | |
| 初始时(mol) | 2.050 | 0.200 | 0 | 0 |
| 平衡时(mol) | 2.000 | 0.100 | 0.050 | 0.050 |
| A. | 该反应的平衡常数为$\frac{1}{4}$ | |
| B. | 增加活性炭的量,能缩短达到平衡所用的时间 | |
| C. | 容器中压强不变可以说明该反应达到平衡状态 | |
| D. | 达到平衡时,用E表示该反应的速率为0.01 mol•L-1•min-1 |
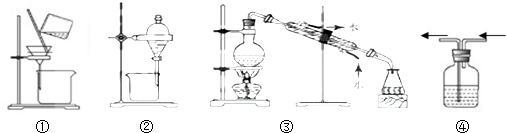
20.下列实验,所选装置合理的是
 ( )
( )
 ( )
( )| A. | 提纯含NaCl的氢氧化铁胶体用装置① | |
| B. | 分离碘的四氯化碳溶液用② | |
| C. | 分离NaCl的酒精溶液用装置③ | |
| D. | 除去Cl2中的HCl气体用装置④ |
 某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则
某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则
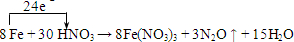 .
.