题目内容
14.恒容密闭容器中的可逆反应H2(g)+I2(g)?2HI(g),达到反应限度时的标志是( )| A. | 混合气体的密度恒定不变 | B. | 混合气体的颜色不再改变 | ||
| C. | H2、I2、HI的浓度相等 | D. | 气体总物质的量不变 |
分析 反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,可由此进行判断.
解答 解:A、根据质量守恒定律知,反应前后混合物的质量始终不变,恒容容器中容器的体积不变,容器内气体的密度始终不变,故A错误;
B、该反应中碘有颜色,其他物质无颜色,当反应达到平衡状态时,各种物质的物质的量、浓度等不再发生变化,所以混合气体的颜色不再改变,故B正确;
C、平衡时,各物质的浓度与反应的初始浓度、转化率有关,所以H2、I2、HI的浓度相等不是化学平衡状态的标志,故C错误;
D、该反应是反应前后气体体积不变的化学反应,无论反应是否达到平衡状态混合气体的物质的量始终恒定不变,所以气体物质的量始终不变不能判断化学平衡状态,故D错误;
故选B.
点评 本题考查了化学平衡状态的判断,难度不大,注意压强对反应前后气体体积不变的化学平衡无影响,只影响其反应速率.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.下列叙述中不正确的是( )
| A. | 油脂属于酯类 | |
| B. | 糖类、油脂、蛋白质都是高分子化合物 | |
| C. | 煤的干馏产物中含有芳香烃 | |
| D. | 质量相等的乙烯和丙烯完全燃烧消耗的氧气的物质的量相同 |
9.下列反应属于吸热反应的是( )
| A. | 二氧化碳与炭反应 | B. | 氢氧化钠溶液与盐酸反应 | ||
| C. | 锌片与稀硫酸反应 | D. | 钠与冷水反应 |
6.阿伏加德罗常数约为6.02×1023mol-1,下列说法正确的是( )
| A. | 标准状况下22.4 L NO与11.2 L O2混合后所得气体分子数为6.02×1023 | |
| B. | 标准状况下3.36 L CCl4含碳原子数为0.15×6.02×1023 | |
| C. | 1 mol甲基(-CH3)中所含电子数为9×6.02×1023 | |
| D. | 2 L 1 mol•L-1 的盐酸中所含氯化氢分子数为2×6.02×1023 |
3.用1mol•L-1的盐酸与锌反应来制取H2,为了加快反应速率,可采取的措施是( )
| A. | 加入相同物质的量浓度的盐酸 | B. | 加入相同物质的量浓度的硝酸 | ||
| C. | 加入相同物质的量浓度的硫酸 | D. | 加入少量的氯化钠溶液 |

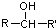
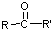 ,
, 不易被氧化成羧酸
不易被氧化成羧酸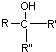 不易被氧化成醛或酮
不易被氧化成醛或酮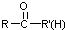
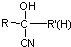
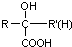 (R、R′、R″均代表烃基 )
(R、R′、R″均代表烃基 )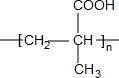 ;
; ;
; ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题: ,这样排布遵循了能量最低、泡利原理和洪特规则.
,这样排布遵循了能量最低、泡利原理和洪特规则.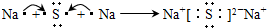 .
.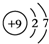 ,五种元素原子半径从大到小的顺序是Na、Si、O、F、H(填元素符号);
,五种元素原子半径从大到小的顺序是Na、Si、O、F、H(填元素符号); ,ED4的电子式是
,ED4的电子式是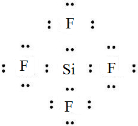 ;
;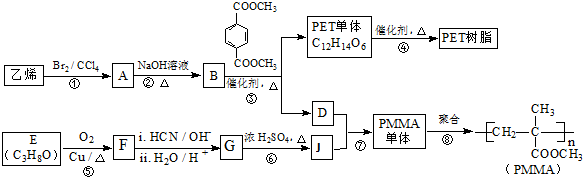 已知:
已知: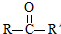
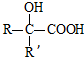 (R、R’代表烃基)
(R、R’代表烃基) .
. .
. .
.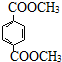 与足量NaOH溶液反应时,最多消耗4mol NaOH
与足量NaOH溶液反应时,最多消耗4mol NaOH