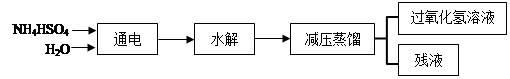
题目内容
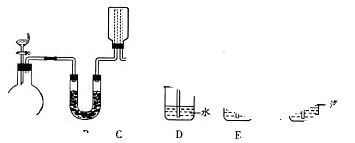
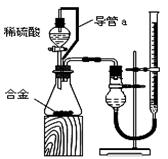
(15分)某化学课外小组用下图装置制取溴苯。
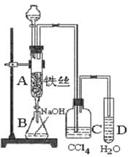
(1)向分液漏斗中加入的试剂是_______________,将试剂慢慢滴入反应器A(A下端活塞关闭)中。
(2) 写出A中反应的化学方程式_______________ 观察到A中的现象是 。
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是 ,写出有关的化学方程式 。然后向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是______;经以上分离操作后,粗溴苯中还含有的主要杂质为______,要进一步提纯,下列操作中必须的是______(填入正确选项前的字母);
A重结晶 B过滤 C蒸馏 D萃取
(4)C中盛放CCl4的作用是 。
(5)D处导管口可看到的现象是__________________,向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明该反应类型是_____________________。另一种验证的方法是向试管D中加入 ,现象是 。

(1)向分液漏斗中加入的试剂是_______________,将试剂慢慢滴入反应器A(A下端活塞关闭)中。
(2) 写出A中反应的化学方程式_______________ 观察到A中的现象是 。
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是 ,写出有关的化学方程式 。然后向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是______;经以上分离操作后,粗溴苯中还含有的主要杂质为______,要进一步提纯,下列操作中必须的是______(填入正确选项前的字母);
A重结晶 B过滤 C蒸馏 D萃取
(4)C中盛放CCl4的作用是 。
(5)D处导管口可看到的现象是__________________,向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明该反应类型是_____________________。另一种验证的方法是向试管D中加入 ,现象是 。
(15分) (1)苯 液溴 (2)有红棕色气体充满A容器C6H6 + Br2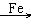 C6H5Br + HBr
C6H5Br + HBr
(3)除去溶于溴苯中的溴 Br2 + 2NaOH → NaBr + NaBrO + H2O;干燥;苯;C
(4)除去溴化氢气体中的溴蒸气
(5) 白雾 取代反应 石蕊试液,溶液变红色(其他合理答案均可)
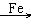 C6H5Br + HBr
C6H5Br + HBr(3)除去溶于溴苯中的溴 Br2 + 2NaOH → NaBr + NaBrO + H2O;干燥;苯;C
(4)除去溴化氢气体中的溴蒸气
(5) 白雾 取代反应 石蕊试液,溶液变红色(其他合理答案均可)
(1)制取溴苯的试剂是苯和液溴,所以分液漏斗中盛放的是苯和液溴。
(2)由于反应放热,而液溴易挥发,所以实验现象是有红棕色气体充满A容器,反应的方程式是C6H6 + Br2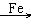 C6H5Br + HBr。
C6H5Br + HBr。
(3)由于生成的溴苯中,含有单质溴,所以氢氧化钠溶液的作用是除去溶于溴苯中的溴,反应的方程式是 Br2 + 2NaOH → NaBr + NaBrO + H2O。氯化钙易吸水,所以作用是干燥;由于苯和溴苯都是易溶的,所以溴苯中还含有的物质是苯,需要通过蒸馏的方法除去,即答案选C。
(4)由于单质溴易溶在有机溶剂中,所以四氯化碳的作用是除去溴化氢气体中的溴蒸气,易防止干扰后面的实验。
(5)溴化氢极易和水蒸气结合形成白雾,实验现象是有白雾生成;淡黄色沉淀是溴化银,这说明有溴化氢生成,一层是取代反应;由于溴化氢溶于水显强酸性,所以也可以通过石蕊试液进行验证,而实验现象是溶液显红色。
(2)由于反应放热,而液溴易挥发,所以实验现象是有红棕色气体充满A容器,反应的方程式是C6H6 + Br2
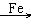 C6H5Br + HBr。
C6H5Br + HBr。(3)由于生成的溴苯中,含有单质溴,所以氢氧化钠溶液的作用是除去溶于溴苯中的溴,反应的方程式是 Br2 + 2NaOH → NaBr + NaBrO + H2O。氯化钙易吸水,所以作用是干燥;由于苯和溴苯都是易溶的,所以溴苯中还含有的物质是苯,需要通过蒸馏的方法除去,即答案选C。
(4)由于单质溴易溶在有机溶剂中,所以四氯化碳的作用是除去溴化氢气体中的溴蒸气,易防止干扰后面的实验。
(5)溴化氢极易和水蒸气结合形成白雾,实验现象是有白雾生成;淡黄色沉淀是溴化银,这说明有溴化氢生成,一层是取代反应;由于溴化氢溶于水显强酸性,所以也可以通过石蕊试液进行验证,而实验现象是溶液显红色。

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
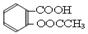 )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下: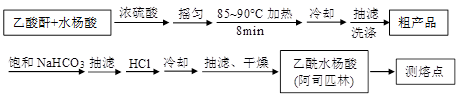
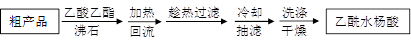 改进的提纯方法中加热回流的装置如图所示
改进的提纯方法中加热回流的装置如图所示
 [方案一]
[方案一] 105Pa)的体积。
105Pa)的体积。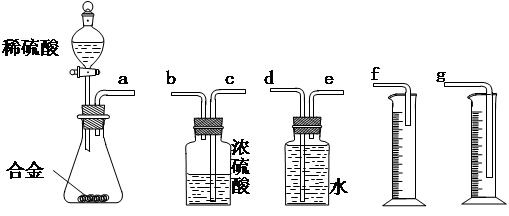
 (NH4)2S2O8+H2↑,
(NH4)2S2O8+H2↑,