题目内容
(每空2分,共16分)铝镁合金已成为飞机制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%-5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。
 [方案一]
[方案一]
 〖实验方案〗将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
〖实验方案〗将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。 实验中发生反应的化学方程式是 。
实验中发生反应的化学方程式是 。
 〖实验步骤〗
〖实验步骤〗
 (1)称取5.4g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中。为使其反应完全,则NaOH溶液的体积V ≥ 。
(1)称取5.4g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中。为使其反应完全,则NaOH溶液的体积V ≥ 。
 (2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将  (填“偏高”、“偏低”或“无影响”)。
(填“偏高”、“偏低”或“无影响”)。
 [方案二
[方案二
 ]
]
〖实验方案〗将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01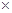 105Pa)的体积。
105Pa)的体积。
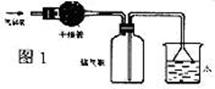
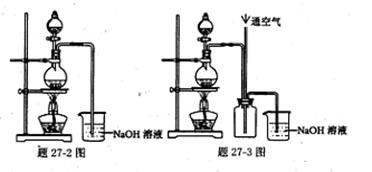
 〖问题讨论〗(1)同学们拟选用下列实验装置完成实验:
〖问题讨论〗(1)同学们拟选用下列实验装置完成实验:







 ①你认为最简易的装置其连接顺序是:a接( )( )接( )( )接( )(填接口字母,可不填满。)
①你认为最简易的装置其连接顺序是:a接( )( )接( )( )接( )(填接口字母,可不填满。)
 ②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开分液漏斗可旋转的活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶中。请你帮助分析原因 。
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开分液漏斗可旋转的活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶中。请你帮助分析原因 。
 ③实验结束时,在读取测量实验中生成氢气的体积时,你认为最合理的顺序是 。
③实验结束时,在读取测量实验中生成氢气的体积时,你认为最合理的顺序是 。

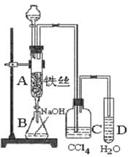
 (2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了右图所示的实验装置。
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了右图所示的实验装置。
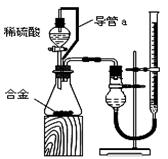
 ①装置中导管a的作用是 。
①装置中导管a的作用是 。
 ②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为_________mL。
②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为_________mL。



 [方案一]
[方案一] 〖实验方案〗将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
〖实验方案〗将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。 实验中发生反应的化学方程式是 。
实验中发生反应的化学方程式是 。 〖实验步骤〗
〖实验步骤〗 (1)称取5.4g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中。为使其反应完全,则NaOH溶液的体积V ≥ 。
(1)称取5.4g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中。为使其反应完全,则NaOH溶液的体积V ≥ 。 (2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将  (填“偏高”、“偏低”或“无影响”)。
(填“偏高”、“偏低”或“无影响”)。 [方案二
[方案二
 ]
]〖实验方案〗将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01
 105Pa)的体积。
105Pa)的体积。 〖问题讨论〗(1)同学们拟选用下列实验装置完成实验:
〖问题讨论〗(1)同学们拟选用下列实验装置完成实验:







 ①你认为最简易的装置其连接顺序是:a接( )( )接( )( )接( )(填接口字母,可不填满。)
①你认为最简易的装置其连接顺序是:a接( )( )接( )( )接( )(填接口字母,可不填满。) ②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开分液漏斗可旋转的活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶中。请你帮助分析原因 。
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开分液漏斗可旋转的活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶中。请你帮助分析原因 。 ③实验结束时,在读取测量实验中生成氢气的体积时,你认为最合理的顺序是 。
③实验结束时,在读取测量实验中生成氢气的体积时,你认为最合理的顺序是 。
A.等待实验装置冷却 | B.上下移动量筒f,使其中液面与广口瓶中液面相平 | C.上下移动量筒g,使其中液面与广口瓶中液面相平 | D.视线与凹液面的最低点水平读取量筒中水的体积 |
 (2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了右图所示的实验装置。
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了右图所示的实验装置。
 ①装置中导管a的作用是 。
①装置中导管a的作用是 。 ②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为_________mL。
②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为_________mL。



(每空2分,共16分) [方案一
[方案一 ]〖实验方案〗 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
]〖实验方案〗 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
(1) 97mL (2) 偏高
[方案二](1)① edg
② 锌与稀硫酸反应放热且生成气体,使锥形瓶中气体压强变大 ③ ACD
(2)①使分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下;滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差。 ② V1-V2
 [方案一
[方案一 ]〖实验方案〗 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
]〖实验方案〗 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ (1) 97mL (2) 偏高
[方案二](1)① edg
② 锌与稀硫酸反应放热且生成气体,使锥形瓶中气体压强变大 ③ ACD
(2)①使分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下;滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差。 ② V1-V2
[方案一]由于镁和氢氧化钠不反应,而铝是反应的,所以反应的方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑;合金中铝的质量最多是5.4g×0.97,则物质的量的是0.2mol×0.97,因此需要氢氧化钠是0.2mol×0.97,所以氢氧化钠溶液溶液的体积至少是97mol;由于固体会吸附某些离子,所以固体的质量会增加,则镁的质量分数将偏高。
[方案二](1)①由于通过排水法测量气体的体积,因此不需要干燥气体,所以最简易的装置其连接顺序是aedg。
②稀硫酸不能滴下,说明容器内压强大于大气压,这是由于锌和稀硫酸的反应是放热反应,且生成氢气,导致压强增大,液体不能滴下。
③读数时必需保证容器内外压强是相同的,所以选项ACD正确,答案选ACD。
(2)①为了使稀硫酸顺利滴下,且消除由于加入稀硫酸引起的氢气体积误差,所以其作用是使分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下;滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差。
②碱式滴定管中液面的前后差值就是生成的氢气体积,所以氢气的体积是 V1-V2ml。
[方案二](1)①由于通过排水法测量气体的体积,因此不需要干燥气体,所以最简易的装置其连接顺序是aedg。
②稀硫酸不能滴下,说明容器内压强大于大气压,这是由于锌和稀硫酸的反应是放热反应,且生成氢气,导致压强增大,液体不能滴下。
③读数时必需保证容器内外压强是相同的,所以选项ACD正确,答案选ACD。
(2)①为了使稀硫酸顺利滴下,且消除由于加入稀硫酸引起的氢气体积误差,所以其作用是使分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下;滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差。
②碱式滴定管中液面的前后差值就是生成的氢气体积,所以氢气的体积是 V1-V2ml。

练习册系列答案
相关题目

 ,保留小数点后一位,并忽略装置中原有空气的影响)
,保留小数点后一位,并忽略装置中原有空气的影响)