题目内容
(12分)I.在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙和一种氮肥。请根据要求答问题:
(1)写出该反应的化学方程式 。
(2)如何判断所得碳酸钙是否为纳米级 。
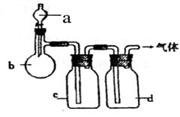
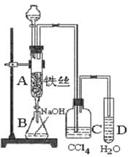
Ⅱ.某实验小组设计下图装置测定SO2转化成SO3的转化率。已知SO3的熔点16.8℃,沸点是44.8℃。已知发生装置中反应的化学方程式为:
Na2SO3(s)+H2SO4
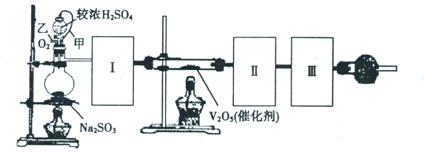
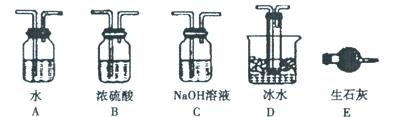
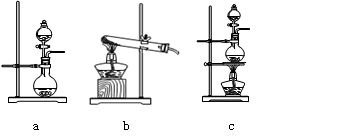
(1)根据实验需要,请从下图A~E装置中选择最适合装置,连接在I、Ⅱ、Ⅲ处。
Ⅰ Ⅱ Ⅲ 。
(2)在检查完装置气密性后,从乙处均匀通入O2,在实验中先加热催化剂后滴加浓硫酸,这样操作后在装置I和装置Ⅱ之间发生的反应的化学方程式 。
(3)发生装置的分液漏斗上接橡皮管甲的目的是 。
(4)用126g Na2SO3粉末与足量浓硫酸进行实验,当反应结束时,继续通入O2一段时间,若测得装置Ⅲ增重了51.2g,则实验中SO2的转化率为 。
(1)写出该反应的化学方程式 。
(2)如何判断所得碳酸钙是否为纳米级 。
Ⅱ.某实验小组设计下图装置测定SO2转化成SO3的转化率。已知SO3的熔点16.8℃,沸点是44.8℃。已知发生装置中反应的化学方程式为:
Na2SO3(s)+H2SO4

(1)根据实验需要,请从下图A~E装置中选择最适合装置,连接在I、Ⅱ、Ⅲ处。
Ⅰ Ⅱ Ⅲ 。

(2)在检查完装置气密性后,从乙处均匀通入O2,在实验中先加热催化剂后滴加浓硫酸,这样操作后在装置I和装置Ⅱ之间发生的反应的化学方程式 。
(3)发生装置的分液漏斗上接橡皮管甲的目的是 。
(4)用126g Na2SO3粉末与足量浓硫酸进行实验,当反应结束时,继续通入O2一段时间,若测得装置Ⅲ增重了51.2g,则实验中SO2的转化率为 。
(本题12分)
I.(1)CaCl2+CO2+2NH3+H2O=CaCO3↓+2NH4Cl(2分)
(2)用一束光照射,若出现一条光亮的通路,则是纳米级碳酸钙,否则不是(2分)
II.(1)B、D、C(全对计2分,只要一个错计0分)
(2)2SO2+ O2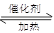 2SO3(略反应条件和可逆号)(2分,反应条件和可逆号各占1分)
2SO3(略反应条件和可逆号)(2分,反应条件和可逆号各占1分)
(3)使分液漏斗和烧瓶内气压平衡,保证较浓硫酸能够顺利流下(2分)
(4))20%(2分)
I.(1)CaCl2+CO2+2NH3+H2O=CaCO3↓+2NH4Cl(2分)
(2)用一束光照射,若出现一条光亮的通路,则是纳米级碳酸钙,否则不是(2分)
II.(1)B、D、C(全对计2分,只要一个错计0分)
(2)2SO2+ O2
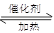 2SO3(略反应条件和可逆号)(2分,反应条件和可逆号各占1分)
2SO3(略反应条件和可逆号)(2分,反应条件和可逆号各占1分)(3)使分液漏斗和烧瓶内气压平衡,保证较浓硫酸能够顺利流下(2分)
(4))20%(2分)
I.(1)根据原子守恒可知,另一种氮肥应该是氯化铵,所以该反应的化学方程式是CaCl2+CO2+2NH3+H2O=CaCO3↓+2NH4Cl。
(2)由于纳米材料的微粒直径介于1nm和100纳米之间,所以纳米材料形成的分散系应该是胶体,而检验是否为胶体的方法是丁达尔效应。即用一束光照射,若出现一条光亮的通路,则是纳米级碳酸钙,否则不是。
II.(1)根据题意可知,实验原理是利用生成的SO2被氧化生成三氧化硫,然后然后分别通过测量剩余的SO2和生成的三氧化硫即可测定SO2转化成SO3的转化率。由于生成的SO2中含有水蒸气,因此首先要干燥SO2,选择浓硫酸。由于三氧化硫的熔点低,剩余通过冰水来来收集生成的三氧化硫,最后剩余的SO2用氢氧化钠溶液吸收,剩余正确的答案选B、D、C。
(2)在催化剂的作用下,SO2被氧化生成三氧化硫,反应的化学方程式是2SO2+ O2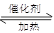 2SO3。
2SO3。
(3)由于在反应中生成气体SO2,所以必须保持内外压强相等,以使浓硫酸顺利滴下,所以作用是使分液漏斗和烧瓶内气压平衡,保证较浓硫酸能够顺利流下。
(4)126g Na2SO3固体可以生成1molSO2,质量是64g,而剩余的SO2气体是51.2g,所以实验中SO2的转化率为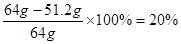 。
。
(2)由于纳米材料的微粒直径介于1nm和100纳米之间,所以纳米材料形成的分散系应该是胶体,而检验是否为胶体的方法是丁达尔效应。即用一束光照射,若出现一条光亮的通路,则是纳米级碳酸钙,否则不是。
II.(1)根据题意可知,实验原理是利用生成的SO2被氧化生成三氧化硫,然后然后分别通过测量剩余的SO2和生成的三氧化硫即可测定SO2转化成SO3的转化率。由于生成的SO2中含有水蒸气,因此首先要干燥SO2,选择浓硫酸。由于三氧化硫的熔点低,剩余通过冰水来来收集生成的三氧化硫,最后剩余的SO2用氢氧化钠溶液吸收,剩余正确的答案选B、D、C。
(2)在催化剂的作用下,SO2被氧化生成三氧化硫,反应的化学方程式是2SO2+ O2
 2SO3。
2SO3。(3)由于在反应中生成气体SO2,所以必须保持内外压强相等,以使浓硫酸顺利滴下,所以作用是使分液漏斗和烧瓶内气压平衡,保证较浓硫酸能够顺利流下。
(4)126g Na2SO3固体可以生成1molSO2,质量是64g,而剩余的SO2气体是51.2g,所以实验中SO2的转化率为
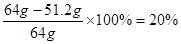 。
。
练习册系列答案
 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案
相关题目
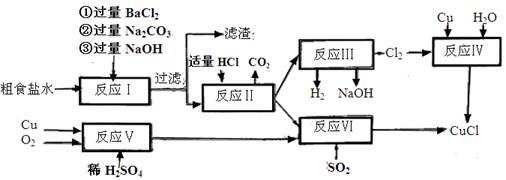
 。
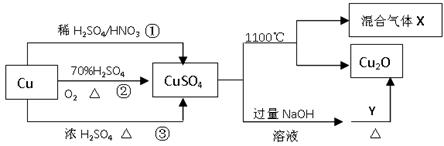
。 2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。

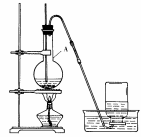
 发生装置(X)的气密性,请写出主要操作过程:
发生装置(X)的气密性,请写出主要操作过程: