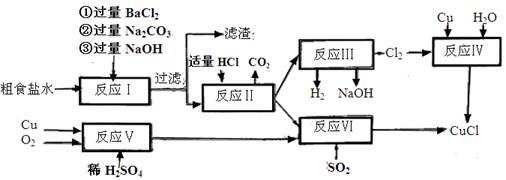
题目内容
(16分)过氧化氢(H2O2)有广泛的用途。工业上用电解硫酸氢铵水溶液的方法制备过氧化氢,其反应原理是:2NH4HSO4 (NH4)2S2O8+H2↑,
(NH4)2S2O8+H2↑,
(NH4)2S2O8+2H2O==2NH4HSO4 + H2O2。其流程如下:
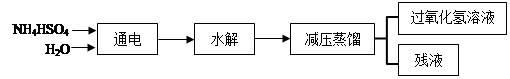
回答下列问题:
(1)根据以上反应原理可知,电解硫酸氢铵溶液时,阴极的电极反应方程式是:
。
(2)在上流程图中,采用减压蒸馏的原因是: 。
可循环利用的物质是 。
(3)过氧化氢具有的化学性质是 。
(4)硫酸铜溶液中混有少量硫酸亚铁。在除去杂质的过程中,使用过氧化氢时反应的离子方程式是_________________________________________________。
(5)在硫酸的存在下,用过氧化氢与乙酸作用制备过氧乙酸(CH3COOOH)的化学方程式是:_______________________________________________________。
 (NH4)2S2O8+H2↑,
(NH4)2S2O8+H2↑, (NH4)2S2O8+2H2O==2NH4HSO4 + H2O2。其流程如下:

回答下列问题:
(1)根据以上反应原理可知,电解硫酸氢铵溶液时,阴极的电极反应方程式是:
。
(2)在上流程图中,采用减压蒸馏的原因是: 。
可循环利用的物质是 。
(3)过氧化氢具有的化学性质是 。
| A.不稳定性 | B.弱碱性 | C.氧化性 | D.还原性 |
(5)在硫酸的存在下,用过氧化氢与乙酸作用制备过氧乙酸(CH3COOOH)的化学方程式是:_______________________________________________________。
(1)2H++2e—==H2↑(2分)
(2)过氧化氢不稳定,受热容易分解,减小气压,使液体沸点降低。(3分);
NH4HSO4或残液(2分) (3)ACD(3分)(答对1个得1分,错选扣1分)
(4)2 Fe2+ + H2O2 + 2H+ ===2Fe3+ + 2H2O(3分)
(5)CH3COOH+H2O2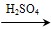 CH3COOOH+H2O(3分)
CH3COOOH+H2O(3分)
(2)过氧化氢不稳定,受热容易分解,减小气压,使液体沸点降低。(3分);
NH4HSO4或残液(2分) (3)ACD(3分)(答对1个得1分,错选扣1分)
(4)2 Fe2+ + H2O2 + 2H+ ===2Fe3+ + 2H2O(3分)
(5)CH3COOH+H2O2
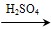 CH3COOOH+H2O(3分)
CH3COOOH+H2O(3分)(1)电解池中阴极是得到电子的,所以溶液中的氢离子放电,方程式是2H++2e—==H2↑。
(2)由于过氧化氢不稳定,受热容易分解,所以减小气压,能使液体沸点降低,易于蒸发出;根据反应流程可知,在生成双氧水的同时,还生成NH4HSO4,所以能循环使用的是NH4HSO4。
(3)过氧化氢不稳定,受热易分解。同时过氧化氢中氧元素的化合价是-1价,处于中间价态,因此既有氧化性,还有还原性,答案选ACD。
(4)过氧化氢还有氧化性,能把亚铁离子氧化生成铁离子,方程式是2 Fe2+ + H2O2 + 2H+ ===2Fe3+ + 2H2O。
(5)根据已知反应物和生成物可知,反应的方程式是
CH3COOH+H2O2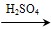 CH3COOOH+H2O
CH3COOOH+H2O
(2)由于过氧化氢不稳定,受热容易分解,所以减小气压,能使液体沸点降低,易于蒸发出;根据反应流程可知,在生成双氧水的同时,还生成NH4HSO4,所以能循环使用的是NH4HSO4。
(3)过氧化氢不稳定,受热易分解。同时过氧化氢中氧元素的化合价是-1价,处于中间价态,因此既有氧化性,还有还原性,答案选ACD。
(4)过氧化氢还有氧化性,能把亚铁离子氧化生成铁离子,方程式是2 Fe2+ + H2O2 + 2H+ ===2Fe3+ + 2H2O。
(5)根据已知反应物和生成物可知,反应的方程式是
CH3COOH+H2O2
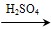 CH3COOOH+H2O
CH3COOOH+H2O
练习册系列答案
相关题目
 KMnO4 + H2C2O4 + ( )---K2SO4 + CO2↑+ MnSO4 + ( )
KMnO4 + H2C2O4 + ( )---K2SO4 + CO2↑+ MnSO4 + ( )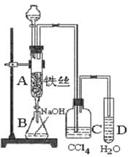
 。
。 2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。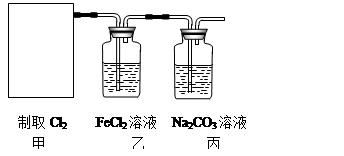
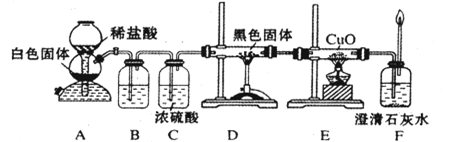
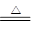 CO+H2 CO + H2O
CO+H2 CO + H2O 2CO
2CO