题目内容
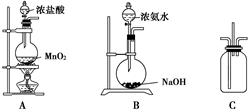
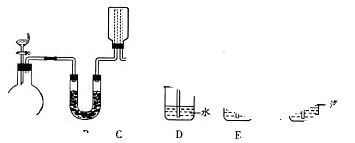
(12分)为探究氨的制取和性质,某兴趣小组的同学进行了如下实验。实验室制取氨气可以将浓氨水滴入生石灰中。装置如图所示。
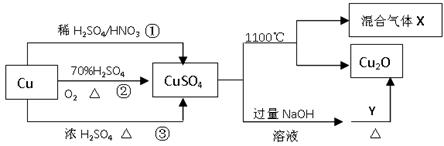
(1)A中发生反应的化学方程式为 ;
(2)若要在C中收集满一瓶干燥的氨气,请在C装置中的虚线上描出导管实线图,B中应装入的试剂是 ;
(3)为吸收处理多余的氨气,可选择D、E、F装置中的 装置;
(4)为探究氨气的还原性,他们往C装置中通入干燥氯气与氨气反应。
①若用二氧化锰与浓盐酸加热制取氯气,为得到干燥纯净的氯气,反应产生的氯气必须依次通过盛有 、 试剂的洗气瓶;
②C中氨气与氯气反应产生白烟,同时生成一种无色无味的气体,反应的化学方程为 ;
③设计实验,检验C中生成的白烟中的阳离子 。

(1)A中发生反应的化学方程式为 ;
(2)若要在C中收集满一瓶干燥的氨气,请在C装置中的虚线上描出导管实线图,B中应装入的试剂是 ;
(3)为吸收处理多余的氨气,可选择D、E、F装置中的 装置;
(4)为探究氨气的还原性,他们往C装置中通入干燥氯气与氨气反应。
①若用二氧化锰与浓盐酸加热制取氯气,为得到干燥纯净的氯气,反应产生的氯气必须依次通过盛有 、 试剂的洗气瓶;
②C中氨气与氯气反应产生白烟,同时生成一种无色无味的气体,反应的化学方程为 ;
③设计实验,检验C中生成的白烟中的阳离子 。
(1)CaO+H2O=Ca(OH)2 (1分)NH3·H2O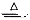 NH3↑+H2O(1分)
NH3↑+H2O(1分)
(2) 碱石灰(1分)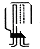 (1分) (3)E(1分)
(1分) (3)E(1分)
(4)①饱和食盐水、 浓硫酸 (各1分)②8NH3+3Cl2=6NH4Cl+N2 (1分)
③取该适量白色固体加入少量水配成溶液,向溶液中加入浓氢氧化钠溶液加热,若有能使湿润红色石蕊试纸变蓝的气体产生,则证明该白烟中有NH4+ (4分,其中操作,试剂,现象,结论各1分)
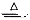 NH3↑+H2O(1分)
NH3↑+H2O(1分) (2) 碱石灰(1分)
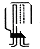 (1分) (3)E(1分)
(1分) (3)E(1分)(4)①饱和食盐水、 浓硫酸 (各1分)②8NH3+3Cl2=6NH4Cl+N2 (1分)
③取该适量白色固体加入少量水配成溶液,向溶液中加入浓氢氧化钠溶液加热,若有能使湿润红色石蕊试纸变蓝的气体产生,则证明该白烟中有NH4+ (4分,其中操作,试剂,现象,结论各1分)
试题分析:(1):应将反应方程式写完整。(2):向下排空气法收集,长进短出。(3): E装置可以防止倒吸。(4):通入饱和食盐水是为了洗去HCl气体,通入浓硫酸吸收水蒸气,干燥气体。
点评:选择气体的发生装置要看反应物的状态和反应条件;气体的收集要看气体的密度和溶解性。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 KMnO4 + H2C2O4 + ( )---K2SO4 + CO2↑+ MnSO4 + ( )
KMnO4 + H2C2O4 + ( )---K2SO4 + CO2↑+ MnSO4 + ( )