题目内容
10.两种短周期元素组成的化合物中,原子个数比为1:3,若两种元素的原子序数分别为a和b,则a和b的关系中可能是( )①a=b+5 ②a+b=30 ③a+b=8 ④a-b=8.
| A. | ②③ | B. | ②③④ | C. | ①②③④ | D. | ③④ |
分析 两种短周期元素组成的化合物中原子数比为1:3,则化学式为AB3型,可能为第ⅢA族与ⅥⅠA组元素组成、可能为第ⅤA族和ⅥⅠA族元素组成、还可能为NH3或SO3,注意C2H6中原子数比为1:3,然后分析原子序数的关系.
解答 解:两种短周期元素组成的化合物中原子数比为1:3,则化学式为AB3型,
两种元素的原子序数分别是a和b,
若为C2H6,则6=1+5,故①可能;
若为AlCl3,则13+17=30,故②可能;
若为NH3,则7+1=8,故③可能;
若为SO3,则16=8+8,故④可能;
显然①②③④都可能,故选C.
点评 本题考查化合物中原子序数的关系,明确常见的AB3型的化合物是解答本题的关键,本题中C2H6为学生思考容易遗漏的问题.

练习册系列答案
相关题目
1.现有部分短周期元素的性质或原子结构如表:
完成下列问题:
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是146C.
(2)元素Y的氢化物的化学式是:NH3.该氢化物可与该元素的最高价氧化物的水化物生成盐,该盐中的化学键类型是离子键、共价键.
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明的是b.
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与NaOH溶液反应
(4)T、X、Y、Z四种元素的最高价氧化物对应的水化物中有一种和其他三种不属于同一类别,该化合物是H2CO3、理由是碳酸是弱酸,其它酸为强酸.
| 元素编号 | 元素性质或原子结构 |
| T | M层上的电子数是原子核外电子层数的2倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物的水溶液呈碱性, |
| Z | 元素最高正价是+7价 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是146C.
(2)元素Y的氢化物的化学式是:NH3.该氢化物可与该元素的最高价氧化物的水化物生成盐,该盐中的化学键类型是离子键、共价键.
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明的是b.
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与NaOH溶液反应
(4)T、X、Y、Z四种元素的最高价氧化物对应的水化物中有一种和其他三种不属于同一类别,该化合物是H2CO3、理由是碳酸是弱酸,其它酸为强酸.
5.X、Y、Z、W是短周期元素,X元素原子的最外层未达到8电子稳定结构,工业上通过分离液态空气获得其单质;Y元素原子最外电子层上s、p电子数相等;Z元素+2价阳离子的核外电子排布与氖原子相同;W元素原子的M层有1个未成对的p电子.下列有关这些元素性质的说法一定正确的是( )
| A. | X元素的氢化物的水溶液显碱性 | |
| B. | Z元素的离子半径大于W元素的离子半径 | |
| C. | Z元素的单质在一定条件下能与X元素的单质反应 | |
| D. | Y元素的氧化物是含有极性键的非极性分子 |
2.下列反应中反应物的总能量比生成物低的是( )
| A. | 镁与二氧化碳反应 | |
| B. | 铁和稀硫酸的反应 | |
| C. | 氢氧化钡晶体的粉末和氯化铵晶体混合 | |
| D. | 木炭在氧气中燃烧 |
3.下面的离子方程式不正确的是( )
| A. | 醋酸的电离:CH3COOH?CH3COO-+H+ | |
| B. | 纯水中水的电离:2H2O?H3O++OH- | |
| C. | 氢硫酸的电离:H2S?2H++S2- | |
| D. | 氯化铁和硫氰化钾反应:Fe3++3SCN-?Fe(SCN)3 |
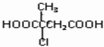 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:(RCH3CH=CH2+HCl$\stackrel{催化剂}{→}$RCH3CHClCH3)
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:(RCH3CH=CH2+HCl$\stackrel{催化剂}{→}$RCH3CHClCH3)  实验室制取乙烯的装置如下图所示,请回答:
实验室制取乙烯的装置如下图所示,请回答:
 .
.