题目内容
11.已知25℃时:①HF(aq)+OH-(aq)═F-(aq)+H2O(l)△H1=-67.7kJ•mol-1
②H+(aq)+OH-(aq)═H2O(l)△H2=-57.3kJ•mol-1
③Ba2+(aq)+SO42-(aq)═BaSO4(s)△H3<0
下列说法正确的是( )
| A. | HF的电离方程式及热效应:HF(aq)═H+(aq)+F-(aq)△H>0 | |
| B. | 在氢氧化钠溶液与盐酸的反应中,盐酸量一定,氢氧化钠溶液量越多,中和热越大 | |
| C. | △H2=-57.3 kJ•mol-1是强酸和强碱在稀溶液中反应生成可溶盐的中和热 | |
| D. | 稀硫酸与稀氢氧化钡溶液反应的热化学方程式为:H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+2H2O(l)△H=-114.6 kJ•mol-1 |
分析 A、利用盖斯定律将①-②可得氢氟酸的电离方程式及热效应;
B、中和热是指强酸强碱稀溶液完全反应生成1mol水放出的热量;
C、H+(aq)+OH-(aq)═H2O(l)△H2=-57.3kJ•mol-1是强酸和强碱在稀溶液中反应生成可溶盐的中和热;
D、稀硫酸与稀氢氧化钡溶液反应生成硫酸钡的过程是放热过程,放出热量大于114.6 kJ.
解答 解:A.利用盖斯定律将①-②可得HF(aq)?F-(aq)+H+(aq)△H=-10.4 kJ•mol-1,△H<0,故A错误;
B、中和热是指强酸强碱稀溶液完全反应生成1mol水放出的热量,和盐酸、氢氧化钠的用量无关,故B错误;
C、H+(aq)+OH-(aq)═H2O(l)△H2=-57.3kJ•mol-1是强酸和强碱在稀溶液中反应生成1mol水和可溶盐的中和热,故C正确;
D、稀硫酸与稀氢氧化钡溶液反应生成硫酸钡的过程是放热过程,放出热量大于114.6 kJ,)△H<-114.6 kJ•mol-1,故D错误;
故选C.
点评 本题考查了热化学方程式书写和盖斯定律应用,中和热概念实质理解应用,掌握基础是解题关键,题目较简单.

练习册系列答案
相关题目
1.某元素质量数52,中子数28,其基态原子未成对电子数为( )
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
6.下列化合物中,属于氧化物的是( )
| A. | Na2SO4 | B. | NaOH | C. | HNO3 | D. | FeO |
16.将1mol CH4和适量的氧气在密闭容器中点燃,充分反应后,甲烷和氧气均无剩余,且产物均为气体(101kPa,120℃),其总质量为72g,下列有关叙述不正确的是( )
| A. | 产物的平均摩尔质量为24 g/mol | |
| B. | 若将产物通过浓硫酸充分吸收后恢复至(101 kPa,120℃),则压强变为原来的$\frac{1}{3}$ | |
| C. | 反应中消耗的氧气为56 g | |
| D. | 若将产物通过碱石灰,则可全被吸收,若通过浓硫酸,则不能被完全吸收 |
3.某校老师和学生用相同质量和相同形状的锌片和不同浓度的足量稀盐酸反应得到实验数据如表所示:
Ⅰ.实验①和②探究的是:(1)温度对反应速率的影响
该反应的离子方程式为:(2)Zn+2H+=Zn2++H2↑.
Ⅱ.实验②和③表明:(3)盐酸浓度越大,化学反应速率越大;
Ⅲ.除上述条件的改变引起速率的改变外,还可能有那些因素加快上述反应速率:
(4)锌的颗粒大小(列举其中一个因素)
Ⅳ.如果把实验③中锌片换成相同质量的铁片,请比较两种金属中那种产生的氢气多并说明原因:
(5)铁产生的氢气多,铁的摩尔质量小于锌,相同质量的铁锌,铁的物质的量多,失电子多(每摩尔铁锌均失2mole-).
| 实验编号 | 盐酸浓度 | 反应温度/℃ | 收集100mL氢气所需时间/s |
| ① | 1mol/L | 15 | 200 |
| ② | 1mol/L | 25 | 90 |
| ③ | 2mol/L | 25 | 10 |
该反应的离子方程式为:(2)Zn+2H+=Zn2++H2↑.
Ⅱ.实验②和③表明:(3)盐酸浓度越大,化学反应速率越大;
Ⅲ.除上述条件的改变引起速率的改变外,还可能有那些因素加快上述反应速率:
(4)锌的颗粒大小(列举其中一个因素)
Ⅳ.如果把实验③中锌片换成相同质量的铁片,请比较两种金属中那种产生的氢气多并说明原因:
(5)铁产生的氢气多,铁的摩尔质量小于锌,相同质量的铁锌,铁的物质的量多,失电子多(每摩尔铁锌均失2mole-).
14.某无色透明的强酸性溶液中,能大量共存的一组离子是( )
| A. | Al3+、SO42-、Cl- | B. | Na+、AlO2- K+、SO42- | ||
| C. | MnO${\;}_{4}^{-}$、K+、SO42-、Na+ | D. | NH4+、NO3-、Fe2+、Cl- |

 ⑥
⑥
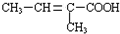 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$
 中任意两种.
中任意两种.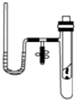 某研究性学习小组在探究化学反应中的能量变化时设计了如图所示的实验装置.
某研究性学习小组在探究化学反应中的能量变化时设计了如图所示的实验装置.