题目内容
13.(1)有下列四种微粒:①${\;}_{8}^{18}$O②${\;}_{11}^{23}$Na③${\;}_{12}^{24}$Mg④${\;}_{7}^{14}$N(用序号填空)Ⅰ.按原子半径由大到小顺序排列是②>③>④>①.
Ⅱ.微粒中质子数小于中子数的是①②.
Ⅲ.在化合物中呈现的化合价的数值最多的是④.
Ⅳ.能形成X2Y2型化合物的是①②,能形成X3Y2型化合物的是③④.
(2)已知An+、B(n+1)+、Cn-、D(n+1)-都具有相同的电子层结构,则A、B、C、D的离子半径由大到小的顺序是D>C>A>B,原子序数由大到小的顺序是B>A>C>D.
分析 (1)I.同周期自左而右原子半径减小,同主族自上而下原子半径增大;
Ⅱ.左下角数字为质子数,左上角数字为质量数,中子数=质量数=质子数;
Ⅲ.N元素化合价有-3、+1、+2、+3、+4、+5;
Ⅳ.X2Y2型化合物的是Na2O2,X3Y2型化合物的是Mg3N2;
(2)An+、B(n+1)+、Cn-、D(n+1)-都具有相同的电子层结构,则核电荷数B>A>C>D,核电荷数越大,离子半径越小.
解答 解:(1)I.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:②>③>④>①,故答案为:②>③>④>①;
Ⅱ.:①${\;}_{8}^{18}$O中质子数为8,中子数为18-8=10,质子数小于中子数,②${\;}_{11}^{23}$Na中质子数为11,中子数为23-11=12,质子数小于中子数,③${\;}_{12}^{24}$Mg中质子数为,12,中子数为24-12=12,质子数等于中子数,④${\;}_{7}^{14}$N中质子数为7,中子数为14-7=7,质子数等于中子数,故答案为:①②;
Ⅲ.N元素化合价有-3、0、+1、+2、+3、+4、+5,化合价最多,故答案为:④;
Ⅳ.X2Y2型化合物的是Na2O2,X3Y2型化合物的是Mg3N2,故答案为:①②;③④;
(2)An+、B(n+1)+、Cn-、D(n+1)-都具有相同的电子层结构,则核电荷数B>A>C>D,即原子序数B>A>C>D,核电荷数越大,离子半径越小,故离子半径:D>C>A>B,
故答案为:D>C>A>B;B>A>C>D.
点评 本题属于拼合型题目,涉及微粒半径比较、原子构成、元素化合价等,比较基础.

练习册系列答案
相关题目
3.有A、B、C、D、E五种短周期元素,其元素特征信息如下表:
回答下列问题:
(1)写出下列元素的名称:C钠,E氯
(2)B、C、D的简单离子半径由大到小的顺序是(用化学式表示)O2->Mg2+>Al3+
(3)①写出E单质与A、B、C形成的化合物反应的化学方程式Cl2+2OH-=Cl-+ClO-+H2O
②D单质与A、B、C形成的化合物的水溶液反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑
(4)用电子式表示C2B的形成过程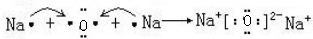 .
.
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
(1)写出下列元素的名称:C钠,E氯
(2)B、C、D的简单离子半径由大到小的顺序是(用化学式表示)O2->Mg2+>Al3+
(3)①写出E单质与A、B、C形成的化合物反应的化学方程式Cl2+2OH-=Cl-+ClO-+H2O
②D单质与A、B、C形成的化合物的水溶液反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑
(4)用电子式表示C2B的形成过程
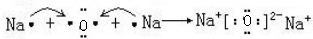 .
.
4.下列关于化学用语的表示正确的是( )
| A. | 过氧化钠的电子式: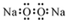 | B. | 中子数为 20 的氯原子:${\;}_{17}^{20}$Cl | ||
| C. | 硫离子的结构示意图: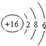 | D. | HCN的结构式:H-C≡N |
1.某元素质量数52,中子数28,其基态原子未成对电子数为( )
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
8.下列物质的熔、沸点高低顺序正确的是( )
| A. | 金刚石>晶体硅>二氧化硅>碳化硅 | B. | CI4>CBr4>CCl4>CH4 | ||
| C. | MgO>Na2O>N2>O2 | D. | 金刚石>生铁>纯铁>钠 |
5.某混合物水溶液,可能含有以下离子中的若干种:K+、NH4+、Cl-、Ca2+、CO32-、SO42-,现每次取100mL溶液分别进行下列实验:下列说法正确的是( )
| 实验编号 | 实验步骤 | 实验现象 |
| ② | 加入AgNO3溶液 | 有沉淀产生 |
| ③ | 加入足量NaOH溶液后加热 | 收集气体0.896L(标准状况) |
| ④ | 加入足量的BaCl2 溶液 | 得到沉淀6.27g,沉淀经足量盐酸洗涤、干燥后,剩余2.33g |
| A. | c(K+)≥0.2 mol/L | |
| B. | 一定存在的离子:Cl-、NH4+、CO32-、SO42- | |
| C. | 一定不存在的离子:Ca2+、K+、Cl- | |
| D. | c(K+)+c(NH4+)=c(CO32-)+c(SO42-) |
3.某校老师和学生用相同质量和相同形状的锌片和不同浓度的足量稀盐酸反应得到实验数据如表所示:
Ⅰ.实验①和②探究的是:(1)温度对反应速率的影响
该反应的离子方程式为:(2)Zn+2H+=Zn2++H2↑.
Ⅱ.实验②和③表明:(3)盐酸浓度越大,化学反应速率越大;
Ⅲ.除上述条件的改变引起速率的改变外,还可能有那些因素加快上述反应速率:
(4)锌的颗粒大小(列举其中一个因素)
Ⅳ.如果把实验③中锌片换成相同质量的铁片,请比较两种金属中那种产生的氢气多并说明原因:
(5)铁产生的氢气多,铁的摩尔质量小于锌,相同质量的铁锌,铁的物质的量多,失电子多(每摩尔铁锌均失2mole-).
| 实验编号 | 盐酸浓度 | 反应温度/℃ | 收集100mL氢气所需时间/s |
| ① | 1mol/L | 15 | 200 |
| ② | 1mol/L | 25 | 90 |
| ③ | 2mol/L | 25 | 10 |
该反应的离子方程式为:(2)Zn+2H+=Zn2++H2↑.
Ⅱ.实验②和③表明:(3)盐酸浓度越大,化学反应速率越大;
Ⅲ.除上述条件的改变引起速率的改变外,还可能有那些因素加快上述反应速率:
(4)锌的颗粒大小(列举其中一个因素)
Ⅳ.如果把实验③中锌片换成相同质量的铁片,请比较两种金属中那种产生的氢气多并说明原因:
(5)铁产生的氢气多,铁的摩尔质量小于锌,相同质量的铁锌,铁的物质的量多,失电子多(每摩尔铁锌均失2mole-).