题目内容
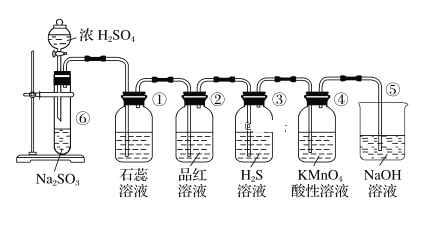
【题目】黄铁矿石的主要成分为FeS2和少量FeS(假设其它杂质中不含铁、硫元素,且高温下不发生化学变化),它是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。将m1g该黄铁矿石的样品放入如图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。其反应的化学方程式为4FeS2+11O2=2Fe2O3+8SO2,4FeS+7O2=2Fe2O3+4SO2
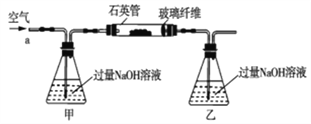
(实验一)测定硫元素的含量
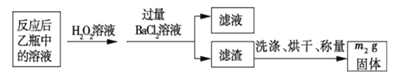
反应结束后,将乙瓶中的溶液进行如下处理:
(1)鼓入空气的作用是_____________________。
(2)反应结束后,给乙瓶溶液中加入足量H2O2溶液的目的是___________(用化学方程式表示)。H2O2可以看成是一种很弱的酸,写出其主要的电离方程式为____________________。
(3)该黄铁砂石中硫元素的质量分数为____________________(列出表达式即可)。
(实验二)测定铁元素的含量
①用足量稀硫酸溶解石英管中的固体残渣②加还原剂使溶液中的Fe3+恰好完全转化为Fe2+后,过滤、洗涤 ③将过滤液稀释至250mL
④取25.00mL稀释液,用0.100mol·L-1的酸性KMnO4溶液滴定
(4)步骤②中,若用铁粉作还原剂,则所测得的铁元素的含量__________(填“偏大”“ 偏小” 或“无影响”)。
(5)请写出步骤②中洗涤的方法____________________。
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
第一次 | 第二次 | 第三次 | 第四次 | |
消耗KMnO4溶液体积/ml | 25.00 | 25.03 | 20.00 | 24.97 |
根据所给数据,计算该稀释液中Fe2+的物质的量浓度c(Fe2+)=__________。
【答案】 提供反应物O2,排尽生成的SO2,使之完全被乙瓶溶液吸收 Na2SO3+H2O2=Na2SO4+H2O H2O2![]() H++HO2-
H++HO2- ![]() ×100% (或
×100% (或![]() ×100%等其他合理答案) 偏大 (沿玻璃棒)向过滤器中加入蒸馏水至浸没固体。(静置)待水自然全部留下,重复操作2~3次 0.5000mol·L-1
×100%等其他合理答案) 偏大 (沿玻璃棒)向过滤器中加入蒸馏水至浸没固体。(静置)待水自然全部留下,重复操作2~3次 0.5000mol·L-1
【解析】(1)鼓入空气的作用显然是提供氧气,并且将生成的SO2完全吹出,使之完全被乙中的氢氧化钠吸收;(2)为减少实验误差,最后使SO32-完全转化成SO42-,从而生成硫酸钡沉淀,双氧水足量时才能将亚硫酸根离子完全转化,反应为Na2SO3+H2O2=Na2SO4+H2O;H2O2是弱酸,电离方程式是H2O2![]() H++HO2-;(3)亚硫酸钠被氧化生成硫酸钠,硫酸根离子和钡离子反应生成白色沉淀硫酸钡,n(BaSO4)=m2g/223g·mol-1=m2/233mol,根据S原子守恒得n(S)=n(BaSO4)=m2/233mol,S元素质量分数=
H++HO2-;(3)亚硫酸钠被氧化生成硫酸钠,硫酸根离子和钡离子反应生成白色沉淀硫酸钡,n(BaSO4)=m2g/223g·mol-1=m2/233mol,根据S原子守恒得n(S)=n(BaSO4)=m2/233mol,S元素质量分数= =
=![]() ;(4)步骤②中,若用铁粉作还原剂,铁和铁离子反应生成的亚铁离子物质的量增大,用高锰酸钾物质的量增大,测定结果偏大;(5)请写出步骤②中洗涤的方法:(沿玻璃棒)向过滤器中加蒸馏水至浸没固体,(静置)待水自然全部流下,重复操作2~3次;(6)依据实验流程,Fe2+被高锰酸钾溶液滴定发生氧化还原反应,高锰酸钾溶液平均消耗体积=
;(4)步骤②中,若用铁粉作还原剂,铁和铁离子反应生成的亚铁离子物质的量增大,用高锰酸钾物质的量增大,测定结果偏大;(5)请写出步骤②中洗涤的方法:(沿玻璃棒)向过滤器中加蒸馏水至浸没固体,(静置)待水自然全部流下,重复操作2~3次;(6)依据实验流程,Fe2+被高锰酸钾溶液滴定发生氧化还原反应,高锰酸钾溶液平均消耗体积=![]() mL=25.00mL(其中20.00ml的数值与其他数据相差较大,舍去);设亚铁离子物质的量为x,依据方程式得到:
mL=25.00mL(其中20.00ml的数值与其他数据相差较大,舍去);设亚铁离子物质的量为x,依据方程式得到:
5 Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O
5 1
x 0.1mol·L-1×0.025L
x=0.0125mol;
c(Fe2+)=0.0125mol/0.025L=0.5000mol·L-1。

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案