题目内容
下列事实中,不能用于判断元素失电子能力强弱的是
| A.金属间发生的置换反应 |
| B.金属元素的最高价氧化物对应水化物的碱性强弱 |
| C.金属元素的单质与水或酸反应置换出氢气的难易 |
| D.每摩尔金属单质在反应中失去电子数目的多少 |
D
解析试题分析:比较元素金属性强弱的一般依据是:1.在一定条件下金属单质与水反应的难易程度和剧烈程度。一般情况下,与水反应越容易、越剧烈,其金属性越强,越易失去电子;2.常温下与同浓度酸反应的难易程度和剧烈程度。一般情况下,与酸反应越容易、越剧烈,其金属性越强,越易失去电子;3.依据最高价氧化物的水化物碱性的强弱。碱性越强,其元素的金属性越强,越易失去电子;4.依据金属单质与盐溶液之间的置换反应。一般是活泼金属置换不活泼金属;5.依据金属活动性顺序表(极少数例外);6.依据元素周期表。同周期中,从左向右,随着核电荷数的增加,金属性逐渐减弱;同主族中,由上而下,随着核电荷数的增加,金属性逐渐增强,据此可以判断。A、金属间发生的置换反应,活泼的金属置换不活泼的金属,可以说明,A不符合题意;B、金属元素的最高价氧化物对应水化物的碱性强弱,金属性越强,最高价氧化物对应水化物的碱性越强,可以说明,B不符合题意;C、金属元素的单质与水或酸反应置换出氢气的难易,金属性越强,越容易置换出氢气,可以说明,C不符合题意;D、金属性强弱与失去电子的多少无关系,只与失去电子的难易程度有关系,所以每摩尔金属单质在反应中失去电子数目的多少不能作为判断元素失电子能力强弱的依据,D符合题意,答案选D。
考点:考查元素金属性强弱的判断依据

下列说法正确的是
A.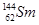 与 与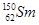 互为同位素 互为同位素 |
| B.氯气能使潮湿的蓝布条变为白色,说明氯气有漂白性 |
| C.将1体积c1mol/L的硫酸用水稀释为5体积,稀溶液的浓度为0.2c1mol/L |
| D.焰色反应一定发生化学变化 |
镭是元素周期表中第7周期第IIA族元素,下列有关叙述不正确的是
| A.镭的金属性比钙弱 | B.单质能与水反应生成H2 |
| C.镭在化合物中呈+2价 | D.碳酸镭难溶于水 |
若某原子的外围电子排布式为4d15s2,则下列说法正确的是
| A.该元素在元素周期表中的位置为第五周期IIIB |
| B.该元素位于s区 |
| C.该元素原子为非金属 |
| D.该元素原子N能层共有8个电子 |
现有三种元素的基态原子的电子排布式如下:① 1s22s22p63s23p1;②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是
| A.第一电离能:③>②>① | B.原子半径:③>②>① |
| C.电负性:①>②>③ | D.最高正化合价:③>②>① |
短周期元素X、Y、Z、W 的原子序数依次增大,且原子最外层电子数之和为13。X 的原子半径比Y 的小,X 与W 同主族,Z 是地壳中含量最高的元素。下列说法正确的是
| A.原子半径的大小顺序: r(Y)>r(Z)>r(W) |
| B.元素Z、W 的简单离子的电子层结构不同 |
| C.元素Y 的简单气态氢化物的热稳定性比Z 的强 |
| D.只含X、Y、Z 三种元素的化合物,可能是离子化合物,也可能是共价化合物 |
前四周期主族非金属元素X、Y、Z和W在元素周期表中的相应位置如图所示。下列说法正确的是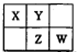
| A.元素X和元素W最高正价代数和一定为8 |
| B.若元素X的原子序数为a,则Z的原子序数一定为a+9 |
| C.常温下,若X的简单氢化物的水溶液能使红色石蕊试液变蓝,则元素Y的简单氢化物的沸点一定高于元素W的简单氢化物 |
| D.原子半径的大小顺序为:rW>rZ>rX>rY |