题目内容
下列说法正确的是
A.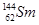 与 与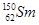 互为同位素 互为同位素 |
| B.氯气能使潮湿的蓝布条变为白色,说明氯气有漂白性 |
| C.将1体积c1mol/L的硫酸用水稀释为5体积,稀溶液的浓度为0.2c1mol/L |
| D.焰色反应一定发生化学变化 |
AC
解析试题分析:A、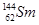 与
与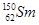 的质子数相同,但质量数不同,因此二者互为同位素,A正确;B、氯气能使潮湿的蓝布条变为白色,是由于氯气与水反应生成次氯酸具有强氧化性导致的,但氯气没有漂白性,B不正确;C、由于在稀释过程中溶质不变,所以将1体积c1mol/L的硫酸用水稀释为5体积,稀溶液的浓度为c1mol/L÷5=0.2c1mol/L,C正确;D、焰色反应是物理变化,D不正确,答案选AC。
的质子数相同,但质量数不同,因此二者互为同位素,A正确;B、氯气能使潮湿的蓝布条变为白色,是由于氯气与水反应生成次氯酸具有强氧化性导致的,但氯气没有漂白性,B不正确;C、由于在稀释过程中溶质不变,所以将1体积c1mol/L的硫酸用水稀释为5体积,稀溶液的浓度为c1mol/L÷5=0.2c1mol/L,C正确;D、焰色反应是物理变化,D不正确,答案选AC。
考点:考查同位素、氯气与氯水性质、溶液稀释以及焰色反应的判断

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案五种短周期元素的某些性质如表所示(其中只有W、Y、Z为同周期元素)。
| 元素代号 | X | W | Y | Z | Q |
| 原子半径(×10-12 m) | 37 | 64 | 66 | 70 | 154 |
| 主要化合价 | +1 | -1 | -2 | +5、-3 | +1 |
下列说法正确的是
A.由Q与Y形成的化合物中只存在离子键
Z与X之间形成的化合物具有还原性
C.由X、Y、Z三种元素形成的化合物,其晶体一定是分子晶体
D.Y与W形成的化合物中,Y显负价
铋(Bi)在医药方面有重要应用。下列关于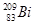 i和
i和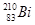 的说法正确的是
的说法正确的是
A.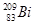 i和 i和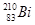 都含有83个中子 都含有83个中子 |
B.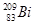 和 和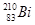 互为同位素 互为同位素 |
C.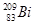 i和 i和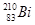 的核外电子数不同 的核外电子数不同 |
D.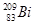 i和 i和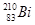 都含有83个质子,是同一种核素 都含有83个质子,是同一种核素 |
图中a、b、c、d、e、f为元素周期表中前4周期的一部分元素,下列有关叙述正确的是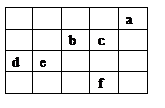
| A.b、c、e三种元素的原子半径大小关系:e>c>b |
| B.六种元素分别形成的单质固体中,d的熔、沸点最高 |
| C.c的氢化物沸点比f的氢化物沸点低 |
| D.b元素除0价外,只有一种化合价 |
砷是第4周期第ⅤA族非金属元素,下列关于砷的推测不正确的是( )
| A.属于短周期元素 | B.可以存在-3、+3、+5等多种化合价 |
| C.砷在通常情况下是固体 | D.最高价氧化物As2O5属于酸性氧化物 |
3He可以作为核聚变材料。下列关于3He的叙述正确的是
| A.3He和3H互为同位素 | B.3He原子核内质子数为3 |
| C.3He原子核内中子数为1 | D.3He原子易失去两个电子 |
X、Y、Z、R为前四周期元素且原子序数依次增大。X的单质与氢气可以化合生成气体G,其水溶液pH>7;Y单质是一种黄色固体;R是一种应用最广的金属,它的一种含氧酸根化学式为RO42-,且具有强氧化性,在其钠盐中加入稀硫酸,溶液变为黄色,并有无色气体产生。Y、Z分别与钠元素可以形成化合物Q和J,J的水溶液与AgNO3溶液反应可生成不溶于稀硝酸的白色沉淀L;Z与氢元素形成的化合物与G反应生成M。则下列说法不正确的是( )
| A.M是离子化合物,且其溶液中阴阳离子个数比为1:l |
| B.L的悬浊液加入Q的溶液,白色沉淀可以转化为黑色沉淀 |
| C.Na2RO4水溶液可以用于杀菌消毒和净水 |
| D.Q的水溶液中加入铝与Z单质形成的化合物,只有白色沉淀生成 |
下列事实中,不能用于判断元素失电子能力强弱的是
| A.金属间发生的置换反应 |
| B.金属元素的最高价氧化物对应水化物的碱性强弱 |
| C.金属元素的单质与水或酸反应置换出氢气的难易 |
| D.每摩尔金属单质在反应中失去电子数目的多少 |
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
| A.原子半径:W>Z>Y>X>M |
| B.XZ2、X2M2、W2Z2均为直线型的共价化合物 |
| C.由X元素形成的单质不一定是原子晶体 |
| D.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |