题目内容
前四周期主族非金属元素X、Y、Z和W在元素周期表中的相应位置如图所示。下列说法正确的是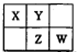
| A.元素X和元素W最高正价代数和一定为8 |
| B.若元素X的原子序数为a,则Z的原子序数一定为a+9 |
| C.常温下,若X的简单氢化物的水溶液能使红色石蕊试液变蓝,则元素Y的简单氢化物的沸点一定高于元素W的简单氢化物 |
| D.原子半径的大小顺序为:rW>rZ>rX>rY |
C
解析试题分析:由元素所在周期表的位置可知x也可能位于ⅣA族或VA族,故A项错;若X位于第三周期,则Z的原子序数为a+19,B项错;常温下,若X的简单氢化物的水溶液能使红色石蕊试液变蓝,则X为N,因H2O分子间存在氢键,故沸点反常,高于HCl,C项正确;同周期元素原子序数大,则其原子半径小,故原子半径顺序为rZ>rW>rX>rY,D项错。
考点:考查元素周期表中“位、构、性”关系,考查考生对元素周期律的理解能力。

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
X、Y、Z、R为前四周期元素且原子序数依次增大。X的单质与氢气可以化合生成气体G,其水溶液pH>7;Y单质是一种黄色固体;R是一种应用最广的金属,它的一种含氧酸根化学式为RO42-,且具有强氧化性,在其钠盐中加入稀硫酸,溶液变为黄色,并有无色气体产生。Y、Z分别与钠元素可以形成化合物Q和J,J的水溶液与AgNO3溶液反应可生成不溶于稀硝酸的白色沉淀L;Z与氢元素形成的化合物与G反应生成M。则下列说法不正确的是( )
| A.M是离子化合物,且其溶液中阴阳离子个数比为1:l |
| B.L的悬浊液加入Q的溶液,白色沉淀可以转化为黑色沉淀 |
| C.Na2RO4水溶液可以用于杀菌消毒和净水 |
| D.Q的水溶液中加入铝与Z单质形成的化合物,只有白色沉淀生成 |
下列事实中,不能用于判断元素失电子能力强弱的是
| A.金属间发生的置换反应 |
| B.金属元素的最高价氧化物对应水化物的碱性强弱 |
| C.金属元素的单质与水或酸反应置换出氢气的难易 |
| D.每摩尔金属单质在反应中失去电子数目的多少 |
YBa2Cu8Ox(Y为元素钇)是磁悬浮列车中的重要超导材料,关于8939Y的说法不正确的是( )
| A.属于金属元素 |
| B.质子数与中子数之差为50 |
| C.原子的核外电子数是39 |
| D.8939Y和9039Y是两种不同的核素 |
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | 啤酒和饮料中常溶有X的最高价氧化物,打开瓶子时,这种氧化物会大量逸出 |
| Y | Y2是空气中含量最高的气体单质 |
| Z | Z的基态原子最外层电子排布式为2s22p4 |
| W | W的一种核素质量数为27,中子数为14 |
(1)W位于元素周期表第 周期第 族;Z和W的最简单的离子半径大小关系为
(用离子符号表示)
(2)一种X形成的单质,是自然界硬度最大的物质,若熔化这种单质,所需克服的微粒间的作用力是 ;Y的电负性比Z (填“大”或“小”)
(3)W的单质与NaOH溶液反应的离子方程式为 , W在高温条件下可还原高熔点的金属氧化物制的金属单质,写出W还原Cr2O3反应的化学方程式: 。
(4)煤燃烧产生的烟气中有Y的氧化物,会引起严重的环境问题,因此,常用XH4催化还原以消除污染,已知:
XH4(g)+2 YO2(g)="=" Y2(g)+ XO2(g)+2H2O (g) △H1= -867kJ/mol
2 YO2(g)
 Y2O4(g) △H2=-56.9kJ/mol
Y2O4(g) △H2=-56.9kJ/mol 下列关于d轨道的说法错误的是( )
| A.M层才开始出现d轨道 |
| B.d轨道最早出现在第4周期元素 |
| C.电子排布时,3d轨道能量高于4s轨道 |
| D.d轨道有10种空间伸展方向 |
下列说法正确的是
| A.金属元素不可能形成含氧酸根离子 |
| B.元素R的含氧酸的化学式是H2RO3,则其气态氢化物的化学式就是RH4 |
| C.金属与非金属元素分界线附近的元素是过渡元素 |
| D.形成化合物种类最多的元素在IVA族 |
下表是元素周期表的一部分,请根据表中a~k对应元素,回答下列有关问题:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | | a | | b | |
| 3 | c | d | e | f | | g | h | |
| 4 | J | | | | | | k | |
(1)写出a的原子的最外层电子排布式 ,a的原子最外层有 个未成对电子。
(1)在上述元素中的最高价氧化物对应的水化物中,最强酸的化学式是 ;最强碱与两性氢氧化物反应的化学方程式为: 。
(1)写出上述元素中和Ar核外电子排布相同的离子半径由大到小的顺序: (用离子符号表示),上述两种元素能结合成XY型离子化合物,且每个阴、阳离子中均含10个电子,已知常温下该物质的水溶液显碱性,其原因是 (用离子方程式表示)。
(1)下列能用作f和g元素非金属性强弱比较的判断依据的是( )
A.单质熔点:
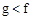
B.最高价氧化物对应水化物的酸性:
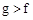
C.最高价氧化物对应水化物的溶解性:
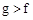
D.f不能与氢气反应,g能与氢气反应