题目内容
镭是元素周期表中第7周期第IIA族元素,下列有关叙述不正确的是
| A.镭的金属性比钙弱 | B.单质能与水反应生成H2 |
| C.镭在化合物中呈+2价 | D.碳酸镭难溶于水 |
A
解析试题分析:镭是元素周期表中第七周期第IIA族元素,与Mg、Ca等金属位于同一主族,性质相似,则A、同主族元素从上到下元素的金属性逐渐增强,因此镭的金属性比钙强,故A错误;B、钙能和水反应生成氢气,镭的金属性强于钙,因此也能与水发生反应生成氢气,故B正确;C、第IIA族元素最外层有2个电子,化合价为+2价,故C正确;D、同主族元素对应的单质或化合物的性质具有相似性,根据碳酸镁、碳酸钙的溶解性难溶可知,碳酸镭难溶于水,故D正确,答案选A。
考点:考查元素周期表的结构和元素周期律的应用

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
铋(Bi)在医药方面有重要应用。下列关于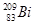 i和
i和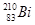 的说法正确的是
的说法正确的是
A.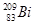 i和 i和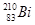 都含有83个中子 都含有83个中子 |
B.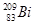 和 和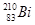 互为同位素 互为同位素 |
C.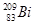 i和 i和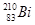 的核外电子数不同 的核外电子数不同 |
D.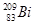 i和 i和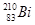 都含有83个质子,是同一种核素 都含有83个质子,是同一种核素 |
3He可以作为核聚变材料。下列关于3He的叙述正确的是
| A.3He和3H互为同位素 | B.3He原子核内质子数为3 |
| C.3He原子核内中子数为1 | D.3He原子易失去两个电子 |
X、Y、Z、R为前四周期元素且原子序数依次增大。X的单质与氢气可以化合生成气体G,其水溶液pH>7;Y单质是一种黄色固体;R是一种应用最广的金属,它的一种含氧酸根化学式为RO42-,且具有强氧化性,在其钠盐中加入稀硫酸,溶液变为黄色,并有无色气体产生。Y、Z分别与钠元素可以形成化合物Q和J,J的水溶液与AgNO3溶液反应可生成不溶于稀硝酸的白色沉淀L;Z与氢元素形成的化合物与G反应生成M。则下列说法不正确的是( )
| A.M是离子化合物,且其溶液中阴阳离子个数比为1:l |
| B.L的悬浊液加入Q的溶液,白色沉淀可以转化为黑色沉淀 |
| C.Na2RO4水溶液可以用于杀菌消毒和净水 |
| D.Q的水溶液中加入铝与Z单质形成的化合物,只有白色沉淀生成 |
已知33As、35Br位于同一周期,下列关系正确的是 ( )
| A.原子半径:As>C1>P | B.热稳定性:HC1>AsH3>HBr |
| C.还原性:As3->S2->C1- | D.酸性:H3AsO4>H2SO4>H3PO4 |
关于卤素(F、Cl、Br、I)的化学性质的叙述,错误的是
| A.随原子序数逐渐增大,单质跟水的反应能力逐渐减弱 |
| B.随原子序数逐渐增大,单质的氧化性逐渐减弱 |
| C.将氯水加到KI-淀粉溶液中,溶液变蓝 |
| D.随原子序数逐渐增大,氢化物的稳定性逐渐增强 |
下列事实中,不能用于判断元素失电子能力强弱的是
| A.金属间发生的置换反应 |
| B.金属元素的最高价氧化物对应水化物的碱性强弱 |
| C.金属元素的单质与水或酸反应置换出氢气的难易 |
| D.每摩尔金属单质在反应中失去电子数目的多少 |
下列关于d轨道的说法错误的是( )
| A.M层才开始出现d轨道 |
| B.d轨道最早出现在第4周期元素 |
| C.电子排布时,3d轨道能量高于4s轨道 |
| D.d轨道有10种空间伸展方向 |