题目内容
13.破坏1molH-H键、Cl-Cl键和H-Cl键分别需要吸收436kJ、243kJ和431kJ的能量,请用此数据估计,由Cl2和H2反应生成2molHCl时总的过程需要放热(填吸或放)183KJ.分析 反应方程式为:H2+Cl2=2HCl,化学反应中,旧键断裂吸收能量,形成新键放出能量,根据反应Cl2+H2=2HCl键能计算反应热.
解答 解:反应方程式为:H2+Cl2=2HCl,
生成2molHCl,需吸收能量:436kJ+243kJ=679kJ,
放出能量:2×431kJ=862kJ,
放出的能量大于吸收的能量,则该反应放热,
且放出:862kJ-679kJ=183kJ,
故答案为:放;183.
点评 本题考查反应热计算,题目难度不大,本题注意化学键的断裂与形成与反应热的关系,注意根据化学方程式计算.

练习册系列答案
相关题目
4.我国某城市的空气成分有①N2 ②①N2 ②O2 ③CO2 ④Ar ⑤SO2 ⑥NO2 ⑦颗粒物.其中能导致酸雨的是( )
| A. | ⑤⑥ | B. | ③⑤⑦ | C. | ④⑤⑦ | D. | ③④⑤⑥⑦ |
8.运用元素周期律分析下面的推断正确的是( )
| A. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| B. | 砹单质是一种有色固体,砹化氢很不稳定,砹化银是难溶于水的白色沉淀 | |
| C. | 碳酸铯受热易分解 | |
| D. | 硒化氢是无色、有毒、比硫化氢稳定的气体 |
18.下列物质中:互为同分异构体的是( )
| A. | 液氯、氯气 | B. | CH2=CH-CH3 CH3-CH2-CH3 | ||
| C. | N2、CO | D. |  、 、 |
2.在一个密闭容器中盛有N2和H2,它们的起始浓度分别是1.8mol/L和5.4mol/L,在一定的条件下它们反应生成NH3,10min后测得N2的浓度是0.8mol/L,则在这10min内NH3的平均反应速率是( )
| A. | 0.1 mol/(L•min) | B. | 0.2 mol/(L•min) | C. | 0.3 mol/(L•min) | D. | 0.6 mol/(L•min) |
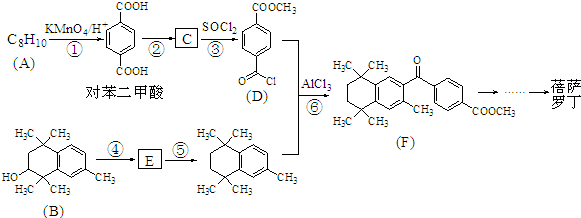
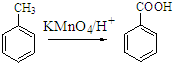
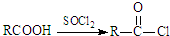
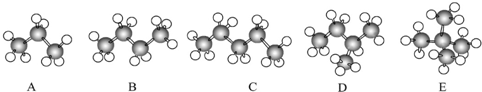
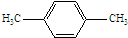 ;原料B发生反应④所需的条件为浓硫酸、加热.
;原料B发生反应④所需的条件为浓硫酸、加热.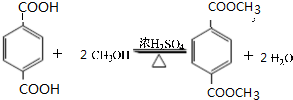 ;⑤
;⑤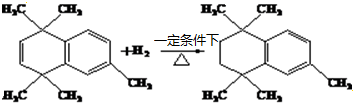 .
. .
.