题目内容
15.已知A2+、B+、C3-、D-是第三周期元素的四种离子.下列叙述中正确的是( )| A. | 四种离子都具有相同的电子层结构 | |
| B. | 原子半径:r(D)>r(C)>r(A)>r(B) | |
| C. | 离子半径:r(B+)>r(A2+)>r(C3-)>r(D-) | |
| D. | B、D两元素的最高价氧化物的水化物在溶液中反应的离子方程式可表示为H++OH-=H2O |
分析 已知A2+、B+、C3-、D-是第三周期元素的四种离子,则A为Mg元素、B为Na元素、C为P元素、D为Cl元素,
A.形成离子时,金属元素失电子,非金属元素得电子;
B.同周期从左到右原子半径依次减小;
C.电子层数越多离子半径越大,电子层数相同时,原子序数越大,离子半径越小;
D.NaOH与高氯酸反应生成盐和水.
解答 解:已知A2+、B+、C3-、D-是第三周期元素的四种离子,则A为Mg元素、B为Na元素、C为P元素、D为Cl元素,
A.形成离子时,金属元素失电子,非金属元素得电子,则Mg、Na的离子只有2个电子层,P、Cl的离子含有3个电子层,所以四种离子电子层结构不同,故A错误;
B.同周期从左到右原子半径依次减小,则原子半径:r(Na)>r(Al)>r(P)>r(Cl),即原子半径:r(B)>r(A)>r(C)>r(D),故B错误;
C.电子层数越多离子半径越大,电子层数相同时,原子序数越大,离子半径越小,则离子半径:r(C3-)>r(D-)>r(B+)>r(A2+),故C错误;
D.NaOH与高氯酸反应生成盐和水,其反应的离子方程式可表示为H++OH-=H2O,故D正确.
故选D.
点评 本题考查了元素的位置、结构和性质的关系,为高考常见题型,难度不大,能根据题意正确判断元素是解本题的关键.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
6.如表是元素周期表的一部分(注意:以下各空所涉及的元素填元素符号,不能用字母代替).
(1)写出元素符号:CAl、ECl;
(2)C的离子的结构示意图 ;
;
(3)用电子式表示AD2的形成过程 ;
;
(4)A-H八种元素中(填元素符号或化学式)
①原子半径最大的元素是K;单质的氧化性最强的元素是F;
②酸性最强的最高价氧化物对应水化物是HClO4;碱性最强的最高价氧化物对应水化物是KOH.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ||||||||
| 2 | G | H | D | |||||
| 3 | B | C | E | |||||
| 4 | F | A |
(2)C的离子的结构示意图
 ;
;(3)用电子式表示AD2的形成过程
 ;
;(4)A-H八种元素中(填元素符号或化学式)
①原子半径最大的元素是K;单质的氧化性最强的元素是F;
②酸性最强的最高价氧化物对应水化物是HClO4;碱性最强的最高价氧化物对应水化物是KOH.
3.茫茫黑夜中,航标灯为航海员指明了方向.航标灯的电源必须长效、稳定.我国科技工作者研制出以铝合金、PtFe合金网为电极材料的海水电池.在这种电池中下列说法正确的是( )
①铝合金是正极 ②铝合金是负极 ③海水是电解质溶液 ④铝合金电极发生还原反应.
①铝合金是正极 ②铝合金是负极 ③海水是电解质溶液 ④铝合金电极发生还原反应.
| A. | ②③ | B. | ②④ | C. | ①② | D. | ①④ |
10.下列实验的设计可行的是( )
| A. | 用澄清石灰水可区别Na2CO3和NaHCO3粉末 | |
| B. |  用如图装置进行浓硝酸与铜的反应制取并收集NO2 用如图装置进行浓硝酸与铜的反应制取并收集NO2 | |
| C. | 检验未知溶液是否含SO42ˉ可先加氯化钡,再加稀盐酸 | |
| D. | 除去粗盐中的Ca2+、Mg2+、SO42-,可依次加入H2O、NaOH、BaCl2、Na2CO3,过滤再加入HCl |
20.若将乙醛通过下列两步反应转变成溴乙烷:CH3CHO$→_{催化剂,△}^{H_{2}}$CH3CH2OH$→_{△}^{+HBr}$CH3CH2Br,这两步反应分别属于有机反应类型中的( )
| A. | 加聚反应和水解反应 | B. | 消去反应和加成反应 | ||
| C. | 加成反应和取代反应 | D. | 加成反应和消去反应 |
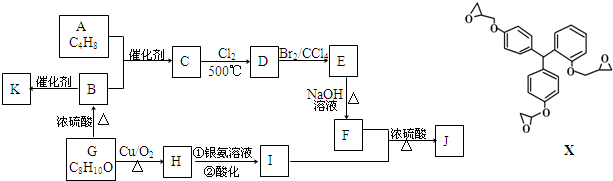
 .
.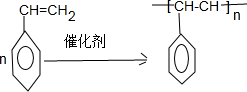 ;F+I→J
;F+I→J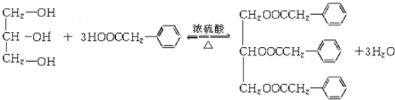 .
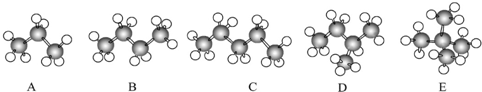
. (其中三种).
(其中三种). (X)为卤素原子.
(X)为卤素原子.
 ;
; ;
; +NaOH$\stackrel{△}{→}$
+NaOH$\stackrel{△}{→}$ +NaCl;
+NaCl; 或
或 .
.