题目内容
11.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 常温下1L 0.1 mol•L-1 NH4NO3溶液中的氮原子数为0.2NA | |
| B. | 含1mol H2SO4的浓硫酸和足量的锌完全反应,转移的电子数为2NA | |
| C. | 标准状况下2.24L己烷分子中含有1.9NA对共用电子 | |
| D. | 以Mg、Al为电极,NaOH溶液为电解质溶液的原电池中,导线上流过NA个电子,则正极放出H2的体积为11.2L |
分析 A.根据n=cV计算出硝酸铵的物质的量,再计算出含有N原子的物质的量;
B.浓硫酸与锌反应生成二氧化硫,稀硫酸与锌反应生成氢气,无法计算转移电子数;
C.标况下己烷的状态不是气体;
D.没有告诉在标况下,无法计算生成氢气的体积.
解答 解:A.1L 0.1mol•L-1的NH4NO3溶液中含有0.1mol溶质硝酸铵,0.1mol硝酸铵中含有0.2molN原子,含有氮原子的数目为0.2NA,故A正确;
B.浓硫酸与锌反应生成硫酸锌和二氧化硫气体,稀硫酸与锌反应生成硫酸锌和氢气,缺少气体的组成情况,无法计算转移电子数,故B错误;
C.己烷在标准状况下的状态不是气体,不能使用标况下的气体摩尔体积计算其物质的量,故C错误;
D.没有告诉在标准状况下,不能使用标况下的气体摩尔体积计算生成氢气的体积,故D错误;
故选A.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件:标准状况下、气体.

练习册系列答案
相关题目
2.甲烷中混有乙烯,欲除去乙烯得到纯净的甲烷,最好依次通过盛有哪些试剂的洗气瓶( )
| A. | 澄清的石灰水,浓硫酸 | B. | 浓硫酸,溴水 | ||
| C. | 溴水,浓硫酸 | D. | 浓硫酸,酸性KMnO4溶液 |
6.设nA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1 mol CH5+所含电子数为8nA | |
| B. | 标准状况下,11.2L Br2中Br原子数为nA | |
| C. | 1mol/L的Al2(SO4)3溶液中Al3+的数目小于2NA | |
| D. | 18g的D216O中含有的中子数为9 NA |
16.下列有机物属于烃的是( )
| A. | CH3Cl | B. | C6H6 | C. | C6H12O6 | D. | CH3CHO |
3.能通过化学反应使溴水褪色,能使高锰酸钾溶液褪色的是( )
| A. | 甲烷 | B. | 乙烯 | C. | 乙烷 | D. | 苯 |
 ,F的电子式为
,F的电子式为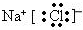 .
.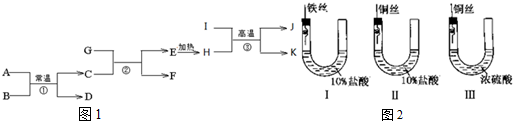
 铁、铜及其化合物在日常生产、生活有着广泛的应用.请回答下列问题:
铁、铜及其化合物在日常生产、生活有着广泛的应用.请回答下列问题: