题目内容
2.甲烷中混有乙烯,欲除去乙烯得到纯净的甲烷,最好依次通过盛有哪些试剂的洗气瓶( )| A. | 澄清的石灰水,浓硫酸 | B. | 浓硫酸,溴水 | ||
| C. | 溴水,浓硫酸 | D. | 浓硫酸,酸性KMnO4溶液 |
分析 乙烯可与溴水反应,而甲烷不能,可利用洗气法,然后干燥得到纯净的甲烷,以此来解答.
解答 解:A.二者均与石灰水不反应,不能除去乙烯,故A不选;
B.最后与溴水反应后,甲烷中可混有水蒸汽,故B不选;
C.先与溴水反应除杂乙烯,而甲烷不能反应,然后干燥得到纯净的甲烷,故C选;
D.最后与酸性KMnO4溶液反应,氧化乙烯生成二氧化碳,引入新杂质,故D不选;
故选C.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与实验能力的考查,注意有机物的性质及差异、除杂的原则,题目难度不大.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
12.用NA表示阿伏伽德罗常数的值.下列叙述正确的是( )
| A. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA | |
| B. | 标准状况下,2.24LCl2与过量的稀NaOH 溶液反应,转移电子总数为0.2NA | |
| C. | 0.1mol•L-1的NH4NO3溶液中氮原子数为0.2NA | |
| D. | 标准状况下,22.4L苯中C-H键数为6NA |
10. (一)实验方法测定反应热---------中和热测定
(一)实验方法测定反应热---------中和热测定
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5mol•L-1 盐酸、0.55mol•L-1NaOH溶液,尚缺少的实验玻璃用品是量筒、温度计.
(2)他们记录的实验数据如下:
已知:Q=Cm(t2-t1),反应后溶液的比热容C为4.18KJ•℃-1•Kg-1,各物质的密度均为1g•cm-3.计算完成表格.△H=-56.8kJ/mol
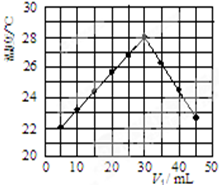
(3)某研究小组将V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).回答下列问题:
研究小组做该实验时环境温度低于(填“高于”、“低于”或“等于”)22℃,此反应所用NaOH溶液的浓度应为1.5mol/L.
(二)通过化学计算间接获得
(1)已知拆开1mol的H-H键、I-I、H-I键分别需要吸收的能量为436kJ、153kJ、299kJ.则反应H2(g)+I2(g)=2HI(g)的反应热△H=-9 kJ•mol-1
(2)已知:2H2(g)+O2(g)=2H2O (l)△H=-571.6kJ•mol-1H2(g)+1/2O2(g)=H2O(g)△H=-241.8kJ•mol-1
根据上述反应确定:H2燃烧热为285.8kJ•mol-1.
 (一)实验方法测定反应热---------中和热测定
(一)实验方法测定反应热---------中和热测定(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5mol•L-1 盐酸、0.55mol•L-1NaOH溶液,尚缺少的实验玻璃用品是量筒、温度计.
| 实 验 用 品 | 溶 液 温 度 | 中和热△H | |||
| t1 | t2 | ||||
| ① | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1Cl | 20℃ | 23.3℃ | |
| ② | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.5℃ | |
已知:Q=Cm(t2-t1),反应后溶液的比热容C为4.18KJ•℃-1•Kg-1,各物质的密度均为1g•cm-3.计算完成表格.△H=-56.8kJ/mol
(3)某研究小组将V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).回答下列问题:
研究小组做该实验时环境温度低于(填“高于”、“低于”或“等于”)22℃,此反应所用NaOH溶液的浓度应为1.5mol/L.
(二)通过化学计算间接获得
(1)已知拆开1mol的H-H键、I-I、H-I键分别需要吸收的能量为436kJ、153kJ、299kJ.则反应H2(g)+I2(g)=2HI(g)的反应热△H=-9 kJ•mol-1
(2)已知:2H2(g)+O2(g)=2H2O (l)△H=-571.6kJ•mol-1H2(g)+1/2O2(g)=H2O(g)△H=-241.8kJ•mol-1
根据上述反应确定:H2燃烧热为285.8kJ•mol-1.
17.下列说法正确的是( )
| A. | 煤的干馏是物理变化 | |
| B. | 石油裂解的目的主要是为了得到更多的汽油 | |
| C. | 石油分馏能得到不同沸点范围的产物 | |
| D. | 石油裂化主得到的是乙烯、丙烯等 |
11.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温下1L 0.1 mol•L-1 NH4NO3溶液中的氮原子数为0.2NA | |
| B. | 含1mol H2SO4的浓硫酸和足量的锌完全反应,转移的电子数为2NA | |
| C. | 标准状况下2.24L己烷分子中含有1.9NA对共用电子 | |
| D. | 以Mg、Al为电极,NaOH溶液为电解质溶液的原电池中,导线上流过NA个电子,则正极放出H2的体积为11.2L |
12.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | 仅含有Na+、H+、OH-、CH3COO-四种离子的某溶液中存在:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | 0.1 mol•L-1NaHCO3溶液与0.1 mol•L-1NaOH溶液等体积混合:c(Na+)=2c(CO${\;}_{3}^{2-}$)+c(HCO${\;}_{3}^{-}$)+2c(H2CO3) | |
| C. | 0.1 mol•L-1NaHCO3溶液与0.2 mol•L-1NaOH溶液等体积混合:c(Na+)>c(OH-)>0.05 mol•L-1>c(CO${\;}_{3}^{2-}$)>c(HCO${\;}_{3}^{-}$) | |
| D. | pH=4.75、浓度均为0.1mol•L-1的CH3COOH和CH3COONa混合溶液:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) |
 路线:
路线:
 .
.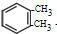 +2Cl2$\stackrel{光照}{→}$
+2Cl2$\stackrel{光照}{→}$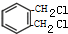 +2HCl
+2HCl
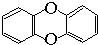 ,其一氯代物有( )
,其一氯代物有( )