题目内容
9.下列离子方程式书写正确的是( )| A. | 过量的SO2通入NaOH溶液中:SO2+2OH-═SO32-+H2O | |
| B. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| C. | 酸性条件下,向含铬废水中加入FeSO4,可将Cr2O72-还原为Cr3+:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O | |
| D. | NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- |
分析 A.反应生成亚硫酸氢钠;
B.碘化氢过量,铁离子和硝酸根离子都完全反应,漏掉了硝酸根离子与碘离子的反应;
C.FeSO4可将Cr2O72-还原为Cr3+;
D.Ba(OH)2过量,碳酸氢根离子完全转化成碳酸钡沉淀,钡离子有剩余.
解答 解:A.过量的SO2通入NaOH溶液中:SO2+OH-═HSO3-,故A错误;
B.硝酸铁溶液中滴加足量HI溶液,铁离子和硝酸根离子都参与反应,正确的离子方程式为:Fe3++3NO3-+12H++10I-=Fe2++5I2+3NO↑+6H2O,故B错误;
C.FeSO4可将Cr2O72-还原为Cr3+:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,故C正确;
D.向NaHCO3溶液中加入过量的Ba(OH)2,反应生成氢氧化钠、水和碳酸钡沉淀,反应的离子方程式为:Ba2++HCO3-+OH-=BaCO3↓+H2O,故D错误.
故选C.
点评 本题考查离子方程式的书写,题目难度中等,本题中注意把握物质的性质以及反应的过量问题,为易错点.

练习册系列答案
相关题目
19.少量铁粉与100mL 0.01mol•L-1的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法的( )
①加H2O ②滴入几滴浓HNO3 ③滴入几滴浓盐酸 ④加少量硫酸铜固体 ⑤加NaCl固体 ⑥升高温度(不考虑盐酸挥发) ⑦改用10mL 0.1mol•L-1盐酸.
①加H2O ②滴入几滴浓HNO3 ③滴入几滴浓盐酸 ④加少量硫酸铜固体 ⑤加NaCl固体 ⑥升高温度(不考虑盐酸挥发) ⑦改用10mL 0.1mol•L-1盐酸.
| A. | ①⑥⑦ | B. | ③⑤⑦ | C. | ③⑥⑦ | D. | ⑤⑥⑦ |
20.取一小段镁带,用砂纸除去表面的氧化膜,放入试管中.向试管中加入2mL水,并滴入2滴酚酞试液.一会儿后发现镁带表面有气泡放出,且镁带附近溶液变红色.加热试管至水沸腾.发现镁带表面有大量气泡放出,且试管中的液体全部变为浅红色.关于该实验下列说法不正确的是( )
| A. | 温度越高,镁与水反应的速率越快 | |
| B. | 镁与水反应的化学方程式为:Mg+2H2O═Mg(OH)2+H2↑ | |
| C. | 氢氧化镁显碱性,且在水中有一定的溶解性 | |
| D. | 氢氧化镁是离子化合物,它的电子式可表示为: |
17.用等质量的金属钠进行下列实验,其中生成氢气最多的是( )
| A. | 把钠放入足量稀盐酸中 | |
| B. | 将钠用铝箔包好并刺些小孔,再放入水中 | |
| C. | 把钠放入硫酸铜溶液中 | |
| D. | 把钠放入足量水中 |
4.下列有关物质结构的表述正确的是( )
| A. | 乙酸的比例模型: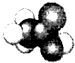 | B. | CO2的电子式: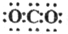 | ||
| C. | 乙醛结构简式:CH3COH | D. | 氯原子的结构示意图: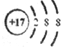 |
14.下列氢化物中最稳定的是( )
| A. | HCl | B. | HBr | C. | HI | D. | H2S |
1.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 常温常压下,Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.4NA | |
| B. | 在反应KIO3+6HI═KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA | |
| C. | 标准状况下,11.2 L的SO3所含分子数为0.5NA | |
| D. | 室温下,8 g甲烷含有共价键数为2NA |
18.若NA表示阿佛加德罗常数,下列说法正确的是( )
| A. | 1 mol氦气分子中含2NA个氦原子 | |
| B. | 25℃时,l L pH=13的Ba(OH)2 溶液中含有Ba2+的数目为0.1NA | |
| C. | 在标准状况下,22.4L空气中约有NA个气体分子 | |
| D. | 在0℃,101kPa时,22.4L氢气中含有NA个氢原子 |
19.下列各组离子在水中一定能大量共存,并形成无色透明溶液的是( )
| A. | Fe2+、OH-、SO42- | B. | H+、Na+、HCO3- | C. | NH4+、H+、NO3- | D. | K+、H+、MnO4- |