题目内容
17.用等质量的金属钠进行下列实验,其中生成氢气最多的是( )| A. | 把钠放入足量稀盐酸中 | |
| B. | 将钠用铝箔包好并刺些小孔,再放入水中 | |
| C. | 把钠放入硫酸铜溶液中 | |
| D. | 把钠放入足量水中 |
分析 Na和水反应生成NaOH和氢气,生成的NaOH溶液能和Al发生反应生成氢气,NaOH能和硫酸铜发生复分解反应生成氢氧化铜,据此分析解答.
解答 解:A.钠和足量稀盐酸反应方程式为2Na+2HCl=2NaCl+H2↑;
B.发生的反应为2Na+2H2O=2NaOH+H2↑、2NaOH+2Al+2H2O=2NaAlO2+3H2↑;
C.发生的反应为2Na+2H2O=2NaOH+H2↑、2NaOH+CuSO4=Cu(OH)2↓+Na2SO4;
D.发生的反应为2Na+2H2O=2NaOH+H2↑;
根据方程式知,只有B中生成的氢气多,故选B.
点评 本题以钠为载体考查化学方程式的有关计算,明确发生的反应是解本题关键,注意铝和NaOH反应能生成氢气,为易错点.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
8.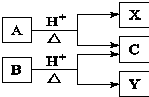 有机物A与B均由C、H、O组成,A与B互为同分异构体,在酸性条件下均可水解,只生成两种有机物.转化关系如图所示.下列有关说法中正确的是( )
有机物A与B均由C、H、O组成,A与B互为同分异构体,在酸性条件下均可水解,只生成两种有机物.转化关系如图所示.下列有关说法中正确的是( )
 有机物A与B均由C、H、O组成,A与B互为同分异构体,在酸性条件下均可水解,只生成两种有机物.转化关系如图所示.下列有关说法中正确的是( )
有机物A与B均由C、H、O组成,A与B互为同分异构体,在酸性条件下均可水解,只生成两种有机物.转化关系如图所示.下列有关说法中正确的是( )| A. | X、Y一定互为同系物 | B. | X、Y的通式一定不同 | ||
| C. | X、Y可能互为同分异构体 | D. | X、Y一定互为同分异构体 |
5.铝粉和铁红的混合物分成两等份,一份直接放入足量的烧碱溶液中;另一份在高温下恰好完全反应,产物再与足量盐酸充分反应.则两种情况下生成的气体体积比(相同条件)是( )
| A. | 2:3 | B. | 3:2 | C. | 1:1 | D. | 2:1 |
12.从下列实验事实所得出的相应结论不正确的是( )
| 实验事实 | 结论 | |
| A | 铁与硫单质生成FeS,与Cl2生成FeCl3 | 氧化性:Cl2>S |
| B | 将CO2通入到Na2SiO3溶液中产生白色浑浊(H2SiO3) | 酸性:H2CO3>H2SiO3 |
| C | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
| D | 某无色溶液加入盐酸酸化的氯化钡溶液产生白色沉淀 | 原溶液一定有SO2−42−4 |
| A. | A | B. | B | C. | C | D. | D |
9.下列离子方程式书写正确的是( )
| A. | 过量的SO2通入NaOH溶液中:SO2+2OH-═SO32-+H2O | |
| B. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| C. | 酸性条件下,向含铬废水中加入FeSO4,可将Cr2O72-还原为Cr3+:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O | |
| D. | NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- |
6.根据碘与氢气反应的热化学方程式
(ⅰ)I2(g)+H2(g)?2HI(g)△H=-9.48kJ/mol
(ⅱ)I2(s)+H2(g)?2HI(g)△H=+26.48kJ/mol
下列判断正确的是( )
(ⅰ)I2(g)+H2(g)?2HI(g)△H=-9.48kJ/mol
(ⅱ)I2(s)+H2(g)?2HI(g)△H=+26.48kJ/mol
下列判断正确的是( )
| A. | 254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ | |
| B. | 1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ | |
| C. | 反应(ⅱ)的反应物总能量比反应(ⅰ)的反应物总能量低 | |
| D. | 反应(ⅰ)的产物比反应(ⅱ)的产物稳定 |
7.下列物质中,能与镁反应并生成氢气的是( )
| A. | CO2 | B. | CH3COOH溶液 | C. | 乙烷 | D. | Na2CO3溶液 |
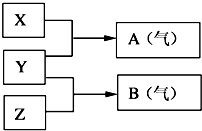 Ⅰ:A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W 同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等.
Ⅰ:A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W 同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等.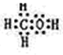 .
.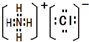 .
.