题目内容
20.取一小段镁带,用砂纸除去表面的氧化膜,放入试管中.向试管中加入2mL水,并滴入2滴酚酞试液.一会儿后发现镁带表面有气泡放出,且镁带附近溶液变红色.加热试管至水沸腾.发现镁带表面有大量气泡放出,且试管中的液体全部变为浅红色.关于该实验下列说法不正确的是( )| A. | 温度越高,镁与水反应的速率越快 | |
| B. | 镁与水反应的化学方程式为:Mg+2H2O═Mg(OH)2+H2↑ | |
| C. | 氢氧化镁显碱性,且在水中有一定的溶解性 | |
| D. | 氢氧化镁是离子化合物,它的电子式可表示为: |
分析 A.将Mg放入试管然后加入水发现有气泡生成,加热至水沸腾,发现镁带表面有大量气泡放出,据此判断温度对化学反应影响;
B.将Mg放入试管然后加入水发现有气泡生成且溶液变红色,酚酞试液遇碱变红色,说明有气体和碱生成;
C.将Mg放入试管然后加入水发现有气泡生成且溶液变红色,酚酞试液遇碱变红色,说明氢氧化镁具有碱性;
D.离子化合物电子式书写时简单阳离子为离子符号,阴离子写出最外层电子数并用[]括起来,并在右上角注明电荷电性.
解答 解:A.将Mg放入试管然后加入水发现有气泡生成,加热至水沸腾,发现镁带表面有大量气泡放出,由此可见温度越高反应速率越快,故A正确;
B.将Mg放入试管然后加入水发现有气泡生成且溶液变红色,酚酞试液遇碱变红色,说明有气体和碱生成,反应方程式为Mg+2H2O═Mg(OH)2+H2↑,故B正确;
C.将Mg放入试管然后加入水发现有气泡生成且溶液变红色,酚酞试液遇碱变红色,说明氢氧化镁具有碱性,氢氧化镁溶解导致溶液呈碱性,溶液变红色,故C正确;
D.氢氧化镁是离子化合物,电子式为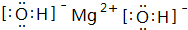 ,故D错误;
,故D错误;
故选D.
点评 本题以镁为载体考查反应速率影响因素、电子式的书写、溶液酸碱性判断等知识点,明确物质结构、性质是解本题关键,注意:镁和冷水不反应,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.聚四氟乙烯的耐热性和化学稳定性超过其他塑料,被称为“塑料王”.其合成路线如下:
三氯甲烷$\stackrel{HF,SbCl_{3}}{→}$二氟一氯甲烷$\stackrel{△}{→}$四氟乙烯$\stackrel{引发剂}{→}$聚四氟乙烯
下列说法中,不正确的是( )
三氯甲烷$\stackrel{HF,SbCl_{3}}{→}$二氟一氯甲烷$\stackrel{△}{→}$四氟乙烯$\stackrel{引发剂}{→}$聚四氟乙烯
下列说法中,不正确的是( )
| A. | 二氟一氯甲院 (CHClF2)中所有原子最外层都达到了8电子稳定结构 | |
| B. | “塑料王”不能使酸性高锰酸钾溶液褪色 | |
| C. | 四氟乙烯 (CF2=CF2)中所有的原子都在同一个平面上 | |
| D. | 三氯甲烷(CHCl3)可以用甲院与氯气的取代反应来制取 |
11.足量的铝分别与等物质的量浓度的稀盐酸、氢氧化钠溶液反应,放出的气体在标准状况下体积相等,则所取稀盐酸和氢氧化钠溶液的体积比为( )
| A. | 3:1 | B. | 3:2 | C. | 1:2 | D. | 6:1 |
8.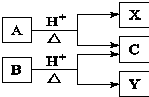 有机物A与B均由C、H、O组成,A与B互为同分异构体,在酸性条件下均可水解,只生成两种有机物.转化关系如图所示.下列有关说法中正确的是( )
有机物A与B均由C、H、O组成,A与B互为同分异构体,在酸性条件下均可水解,只生成两种有机物.转化关系如图所示.下列有关说法中正确的是( )
 有机物A与B均由C、H、O组成,A与B互为同分异构体,在酸性条件下均可水解,只生成两种有机物.转化关系如图所示.下列有关说法中正确的是( )
有机物A与B均由C、H、O组成,A与B互为同分异构体,在酸性条件下均可水解,只生成两种有机物.转化关系如图所示.下列有关说法中正确的是( )| A. | X、Y一定互为同系物 | B. | X、Y的通式一定不同 | ||
| C. | X、Y可能互为同分异构体 | D. | X、Y一定互为同分异构体 |
15.下列关于粒子结构的描述不正确的是( )
| A. | CH3CH(NO2)COOH分子中含有“手性碳原子” | |
| B. | HS-和HC1均是含一个极性键的18电子粒子 | |
| C. | 当用带有静电的玻璃棒接近CH2Cl2和CC14液体细流时,细流都不发生偏转 | |
| D. | 1mol己烷含有的共价键数目为19NA(NA代表阿伏加德罗常数) |
5.铝粉和铁红的混合物分成两等份,一份直接放入足量的烧碱溶液中;另一份在高温下恰好完全反应,产物再与足量盐酸充分反应.则两种情况下生成的气体体积比(相同条件)是( )
| A. | 2:3 | B. | 3:2 | C. | 1:1 | D. | 2:1 |
12.从下列实验事实所得出的相应结论不正确的是( )
| 实验事实 | 结论 | |
| A | 铁与硫单质生成FeS,与Cl2生成FeCl3 | 氧化性:Cl2>S |
| B | 将CO2通入到Na2SiO3溶液中产生白色浑浊(H2SiO3) | 酸性:H2CO3>H2SiO3 |
| C | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
| D | 某无色溶液加入盐酸酸化的氯化钡溶液产生白色沉淀 | 原溶液一定有SO${\;}_{4}^{2-}$ |
| A. | A | B. | B | C. | C | D. | D |
9.下列离子方程式书写正确的是( )
| A. | 过量的SO2通入NaOH溶液中:SO2+2OH-═SO32-+H2O | |
| B. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| C. | 酸性条件下,向含铬废水中加入FeSO4,可将Cr2O72-还原为Cr3+:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O | |
| D. | NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- |
10.下列各组中都属于含极性键的非极性分子的是( )
| A. | CO2、H2S | B. | SO3、CH4 | C. | C60、C2H4 | D. | NH3、HCl |